汉山
标题: 漫談癌症生物療法開發趨勢與臨床試驗設計 [打印本页]
作者: 夺标 时间: 2016-5-1 12:56
标题: 漫談癌症生物療法開發趨勢與臨床試驗設計
編譯: 黃英宜
(原文:Edwards D., Therapy for the Soul, European Biopharmaceutical Review)
癌症生物療法(biologic cancer therapies) 是一種利用自身免疫機制達到抗癌的新型治療方法,透過運用分子生物學和細胞工程技術來提高患者對癌症的免疫性,並補充足夠且功能正常的免疫細胞和相關分子,以激發、增強自身免疫功能,從而達到治療癌症的目的。癌症生物療法的研究正在全球各地積極開展,但精準的臨床試驗設計可說是決定癌症生物治療有無實際臨床應用機會的關鍵。
癌症生物治療可分幾類:
1. 抗體治療:通過單株抗體(monoclonal antibody)對腫瘤細胞產生殺傷作用。
2. 抗體衍生物:雙特異性T細胞治療癌症扣合的抗體(Bi-specific T cell engagers, scFv)是與人類IgG1和IgG2同種型的單株抗體用來研究作為抗癌藥物。他們主導免疫系統,提升T 細胞的細胞毒活性(cytotoxic activity),來對抗腫瘤細胞。
3. 癌症疫苗:癌症疫苗(peptides, DNA 或 腫瘤)的原理是利用疫苗刺激免疫系統中的樹狀細胞(dendritic cell, DC),當樹狀細胞在細胞表面呈現出腫瘤抗原後,除了會直接誘導出細胞毒殺性T淋巴球(Cytotoxic T lymphocyte, CTL),來針對特定的癌細胞進行清除動作,也會刺激輔助型T細胞(Helper T cell, TH cell)分泌細胞激素,間接強化毒殺型T淋巴球對癌細胞的攻擊。
4. 細胞療法:過繼性T細胞療法(adoptive T cell therapy)是為了增強病人的自我免疫系統,進而抵抗腫瘤,先行在體外產生免疫反應,然後將活化的抗原 T 細胞(antigen specific T cell)植回病人體內。
5. 嵌合抗原受體傳導T細胞( chimeric antigen receptor transduced T cells):是一種新的腫瘤免疫治療;傳導T細胞分別與抗原、受體的抗體或是配體結合,融合成T細胞受體。
6. 溶瘤病毒療法 (oncolytic viral therapy):將病毒注入病人的血液,能在不破壞健康人體組織的情況下,穩定甚至縮小癌細胞。
這些生物治療被期望會對疾病產生持續性的良好反應 (prolonged response)。因到目前為止,傳統的細胞毒性癌症治療法從未產生如同生物治療的良性反應。
近年來的生物治療成果令人鼓舞。例如已有調節免疫系統的抗體治療(抗-PD1和 抗-CTLA4 治療)能在患者身上產生超過一年的長期治療效果(2)。此外,過繼性T細胞(adoptive T cell)和嵌合抗原受體傳導T細胞療法(chimeric antigen receptor transduced T cell)亦似乎能產生長期性的病兆緩解功效(remission)(3,4)。不過回顧歷史,生物療法的開發和臨床試驗實際上卻充斥者許多失敗(5,6)。
生物療法自臨床前進入臨床試驗之主要挑戰與風險
對於生物療法而言,即便臨床前實驗資料相當成功,但多數仍未能被成功轉化為臨床上的應用。從臨床前到臨床的轉譯失敗有很多理由,最主要的挑戰和風險包括下列
藥物輸送屏障:淋巴系統其主要功能包括將組織液中過多的水分與蛋白質送入淋巴管以形成淋巴液,在導流送回循環系統中,以維持液體的平衡和血液中蛋白質的濃度。淋巴系統亦能將消化後的脂肪運送至血液中、參與免疫反應、防禦微生物的感染及提供保護的防線。因為腫瘤本身沒有淋巴系統,導致組織中的間質壓力(interstitial pressure)的升高,產生對藥物從血管進入組織的阻礙。而這些因素,限制了生物治療藥物從血管進入腫瘤。病患的血管系統分佈混亂,使得藥物輸送效率不佳。腫瘤缺氧的環境和氧化逆境(oxidative stress)將導致關鍵蛋白減少,如趨化素(chemokines)(注一)、T細胞受體(T cell receptors)及主要組織相容性複合體(major histocompatibility complex,MHC)(注二)的減少,消減其抗腫瘤活性(7)。此外,缺氧環境也抑制了抗腫瘤的免疫系統。(8)
細胞調控機制複雜:不理解腫瘤生物學會產生臨床試驗的失敗。例如,趨化素(chemokine) (注一)可能會減少,所以在癌症疫苗接種後,會抑制毒性T細胞(cytotoxic T cells)之進入,毒性T細胞是一種殺死癌細胞的T 淋巴細胞。抗體治療也會被影響,因抗體依賴性細胞調控毒殺(antibody dependent cell mediated cytotoxicity)作用機制是依賴著腫瘤內足夠數量的自然殺手(Natural Killer, NK)免疫細胞。
動物模式擇選是否適當:由於生物治療往往只在某動物種類有效。抗體治療未能有效的運作在有些動物模式是因為此動物缺乏對抗體有交叉反應的抗原(cross reacting antigen)。例如,類似人腫瘤抗原CEA(human cancer antigen CEA)的抗原不存在於大鼠(rats)或小鼠(mice)體內(9)。國際協調會議(International Conference on Harmonization(ICH))因次建議應該在兩種相關動物物種中評估癌症藥物及生物治療(10,11)。囓齒類(rodent)動物缺乏 CEA. 因此,任何從囓齒類(rodent)動物所獲得的CEA導向治療之安全資料會產生誤導。如果標靶表達只在測試物種裡,將如何與人體組織交叉反應(human tissue cross-reactivity)比較?若沒有理解到組織分佈及輿標靶類似的蛋白質交叉反應,皆會導致錯誤的安全及有效牲資料,甚至錯誤的應用在臨床設計或資料解釋。
囓齒類(rodent)動物模式療效的價值(例如表達CEA癌細胞腺體(cancer cell line)的裸鼠)(注三),通常用在癌症治療研究中是依賴於假設的作用機制。試問:一個由人來源的抗體(humanised antibody)一定會活化小鼠內的殺手細胞(NK)嗎?人體疫苗在小鼠和人類樹突狀細胞(human dendritic cells)內會被同樣的處理嗎?在動物模式和人類裡調控標靶將造成相同的後果嗎?
選擇適當的動物模式,對於後續的臨床成功極為重要。替代療法或基因轉殖動物(transgenic animal)模式都是可用的。然而,這些模式無法模仿每種臨床情況。因此,這些模式較常在臨床實驗只處於支持角色。於是,研究者應瞭解測試種類和患者的相同抗原是什麼。更重要的是,研究者必須瞭解他們之間的抗原差異,才能讓未來進入人體臨床試驗時,能夠確保其風險管理(risk management)。此外,監管毒理學(Regulatory toxicology)和安全藥理學(safety pharmacology)的研究也應輔以確效研究(efficacy studies),以幫助制定首次投藥劑量(starting dose)和投藥劑量頻率(dosing schedule)。雖然臨床前研究不能解決所有的安全性問題,但考量風險與效益比,通常針對晚期癌症病人進行新療法的臨床試驗設計仍能取得有關單位核准,像歐盟的法制意見也對此認同。
生物療法癌症臨床試驗關鍵議題
英國癌症研究中心(Cancer Research UK)是世界上最大的非政府資助癌症研究慈善機構,支助全球五百間學術研究單位從事基礎、轉譯和臨床研究。藥物開發辦公室(The Drug Development Office (DDO))贊助該慈善機構的1-2A期臨床試驗,而臨床試驗案件多來自學術界和工業界,透過臨床開發合作夥伴(Clinical Development Partnership)計畫(13,14)。在DDO管理的超過100個計畫之中,六個計畫-包括帝盟多膠囊(Temozolamide)和阿比特隆(Abiraterone)藥物已獲得銷售許可(marketing authorization)。除了小分子以外,DDO參與肽和DNA疫苗的生物治療研發,亦參與細胞治療、溶瘤病毒(oncolytic viruses)以及抗體和基礎蛋白質生物治療的發展。下述是DDO認為設計癌症臨床實驗時應該特別注意的議題。
患者群
當設計癌症治療的臨床試驗時,我們必須針對-些會影響預測和療效的重要因素如性別、年齡、或腫瘤標靶表達等事先進行分層 (stratification),以利擇選具有target expressing tumor」的病患族群進行試驗,確認生物療法是否可控制或強化免疫反應。此外,在一個病患的癌症過程之中,也需要決定介入治療的時機,以評估什麼時候介入治療患者才有最佳效果。例如,癌症疫苗在晚期/慢性(residual/indolent)疾病中是最有效果。然而,對於癌症晚期患者進行的臨床試驗所引起之反應 (response)改善,其臨床上的意義是否足以鼓勵廠商繼續發展生物治療產品?
伴隨治療 (Concomitant Therapy)
在理想的情況下,對病患的實驗治療(experimental therapy)應是一個唯一的治療,而沒有別的治療伴隨。這獨立的治療結果不會被別的治療影響結果。 然而針對於如膠質母細胞瘤 (Glioblastoma)此種惡性腦腫瘤就無法使用上述之療法,在這種情況下,實驗性治療將伴隨標準治療(Standard of Care ,SoC)同時進行。但此時即須考量同時使用實驗藥物和處方藥物是否會對實驗藥物產生影響?舉個例子,當患者受癌症疫苗治療時。若同時投以有毒性藥物,則有毒性藥物是否將產生骨髓抑制(Myelosuppression)而致使免疫系統減弱。或者,如果同時併用有毒性藥物及實驗性藥物,是否會刺激抑制調節性T細胞(regulatory T-cells)而加強免疫反應?這些都是在進行伴隨治療臨床試驗時需要考量和觀察的重點。
投藥劑量設計 (Dose Schedule)
施以實驗性治療的頻率應是多少?抗體治療時的劑量設計應該要用藥物動力學(pharmacokinetics)來評估。然而癌症疫苗呢?針對沒有表達很多的腫瘤相關抗原(tumor associated antigen),最佳的治療頻率又是多少才能產生保護性免疫反應 (protective immune response)?這些都是劑量設計時需要評估考量的面向。
反應測量 (Measurement of Response)
由於1-2期臨床試驗的低統計效力(statistical power),Overall Survival(OS)(注四)或其Progression-Free Survival(PFS)(注五) 都不能被視為準確的反應標誌 (response marker)(17),因為從過去許多生物治療的臨床試驗可以發現,即便有足夠統計效力,但相較於標準療法,雖然其Overall Survival確實有改進,但是Progression-Free Survival卻沒有變化(18)。
實體腫瘤的療效評價標準(Response Evaluation Criteria in Solid Tumors (RECIST)是用來測量實驗治療對實體腫瘤有無效果的標準評價。當疾病惡化已被這標準證實時,病患將被從臨床試驗中撤出,不再繼續參與臨床試驗。標靶治療或活化人體免疫系統的治療,往往會產生對治療的延遲反應。事實上,當治療產生常見假性惡化(pseudoprogression)現象時,病人即有可能被撤出臨床試驗,即使他們正受益於治療,因此當治療利用了活化人體的免疫系統(19),臨床試驗設計者應考慮應用免疫RECIST標準來評估腫瘤惡化。
癌症生物標記經常需要在1-2期臨床試驗中被驗證其作用機轉,例如Ki67、PCNA、CA125等,或機制標誌物 (mechanistic markers)等,即是調節appropriate host pathways的重要生物標記。因此,仔細評估生物標誌物(Biomarker) 是必要的,以確保有足夠的理由來主張它可被應用於治療上。
結論
總之,近年來生物療法被期望能大大改善癌症病人的治療。然而,此治療的複雜性意味著臨床前和臨床科學家們必須密切合作、共同努力才能成功地將這些實體藥物轉譯為臨床開發之用。
-----------------------------------------------------------------------------------------------------
注一 : 趨化素(Chemokine):是由chemoattractant的首碼加上cytokine的字尾而形成的,其主要功能是將白血球吸引到組織受傷處,使白血球發揮抵抗病原菌,吞噬病原菌以及啟動免疫反應和發炎反應。
注二:主要組織相容性複合體(major histocompatibility complex,MHC):又稱主組織相容性複合基因,是存在於大部分脊椎動物基因組中的一個基因家族,與免疫系統密切相關。存在於細胞表面,是為識別自身而使用的蛋白抗原。與此不符合的細胞或組織,全都視為異物並加以排除。
注三:裸鼠(nude mouse):是一種因遺傳變異(genetic mutation)而導致惡化或不存在胸腺的實驗室小鼠,從而大大減少的T 細胞抑制免疫反應。
注四: Overall Survival : 是臨床試驗常用的評估指標,目的是觀察 從進入臨床試驗到死亡的時間。
注五: Progression-free survival (PFS): 是個臨床試驗的評估指標, 定義的事件包括腫瘤惡化和死亡, 以PFS 為評估指標的臨床試驗, 觀察受試者從進入試驗到腫瘤發生惡化或死亡的時間長度。
References
1. Franks HA, Wang Q and Patel PM, New anticancer immunotherapies, Anticancer Res 32(7): pp2,439-2,453, 2012
2. Lipson EJ et al, Durable cancer regression off-treatment and effective reinduction therapy with an anti-PD-1 antibody, Clin Cancer Res 19(2): pp462-468, 2013
3. Louis CU et al, Antitumor activity and long-term fate of chimeric antigen receptor-positive T cells in patients with neuroblastoma, Blood 118(23): pp6,050-6,056, 2011
4. Kalos M et al, T cells with chimeric antigen receptors have potent antitumor effects and can establish memory in patients with advanced leukemia, Sci Transl Med 3(95): p95ra73, 2011
5. Rao B et al, Clinical outcomes of active specific immunotherapy in advanced colorectal cancer and suspected minimal residual colorectal cancer: a meta-analysis and system review, J Transl Med 9: p17, 2011
6. Wang J et al, Strengths and weaknesses of immunotherapy for advanced non-small-cell lung cancer: a meta-analysis of 12 randomized controlled trials, PLoS One 7(3): pe32695, 2012
7. Lu T and DI Gabrilovich, Molecular pathways: tumor-infiltrating myeloid cells and reactive oxygen species in regulation of tumor microenvironment, Clin Cancer Res 18(18): pp4,877-4,882, 2012
8. Palazon A et al, Molecular pathways: hypoxia response in immune cells fighting or promoting cancer, Clin Cancer Res 18(5): pp1,207-1,213, 2012
9. McCuaig K et al, Expression of the Bgp gene and characterization of mouse colon biliary glycoprotein isoforms, Gene 127(2): pp173-183, 1993
10. Preclinical safety evaluation of biotechology-derived pharmaceuticals, Addendum to ICH: S6(R1), 2009
11. Jones PS and Jones D, New regulatory framework for cancer drug development, Drug Discov Today 17(5-6): pp227-231, 2012
12. Guideline on strategies to identify and mitigate risks for first-in-human clinical trials with investigational medicinal products, EMA, 2007. Visit: www.ema.europa.eu/pdfs/human/ swp/2836707enfin.pdf
13. Williams RJ, Walker I and Takle AK, Collaborative approaches to anticancer drug discovery and development: a Cancer Research UK perspective, Drug Discov Today 17(5-6): pp185-187, 2012
14. CRT, Clinical Development Partnership, 2013. Visit: http://clinicalpartnerships.cancerresearchuk.org
15. Gulley JL, Madan RA and Schlom J, Impact of tumor volume on the potential efficacy of therapeutic vaccines, Curr Oncol 18(3): ppe150-157, 2011
16. Emens LA, Chemoimmunotherapy, Cancer J 16(4): pp295-303, 2010
17. Di Leo A, Bleiberg H and Buyse M, Overall survival is not a realistic end point for clinical trials of new drugs in advanced solid tumors: a critical assessment based on recently reported phase III trials in colorectal and breast cancer, J Clin Oncol 21(10): pp2,045-2,047, 2003
18. Cheever MA and Higano CS, PROVENGE (Sipuleucel-T) in prostate cancer: the first FDA-approved therapeutic cancer vaccine, Clin Cancer Res 17(11): pp3,520-3,526, 2011
19. Wolchok JD et al, Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria, Clin Cancer Res 15(23): pp7,412-7,420, 2009
20. Hoos A et al, Improved endpoints for cancer immunotherapy trials, J Natl Cancer Inst 102(18): pp1,388-1,397, 2010
作者: 夺标 时间: 2016-5-1 13:13
對全球癌症研究的科學家和醫生來說,最令人矚目的行業進展無疑是腫瘤免疫治療。阿斯利康亞洲及新興市場創新醫藥研發副總裁楊青博士用4個多月時間,用文字及手繪圖的形式,對腫瘤免疫治療的發現歷史、思維範式、行業併購等進行了回顧、分析。
作者的話:一個很關鍵、懸而未解的問題是怎樣運用生物標記物依照個性化醫療的原理來挑選最合適接受腫瘤免疫治療的病人。這是從事轉化科學研究的同行們關注的。
在過去的12個月,對我和許多專注癌症研究的同行們是一段激動人心的旅程。 2013年9月,在上海,我們阿斯利康亞洲及新興市場創新醫藥部將公司第一個在中國發現的臨床前候選藥物送入全球腫瘤研發管線上。該項目從啟動到候選藥物投資決定只用了20個月時間。這是我們在中國的創新藥發現工作的一個重要里程碑。 2014年春,我們在英國的腫瘤創新醫藥部的同事們也將針對錶皮生長因子EGFR突變型肺癌的第三代靶向藥物AZD9291推到Ⅲ期臨床試驗階段。當然,對全球癌症研究的科學家和醫生來說,最令人矚目的行業進展無疑是腫瘤免疫治療。
十大科學突破居首
《科學》雜誌將腫瘤免疫治療列為2013年十大科學突破的首位。有關腫瘤免疫治療的臨床試驗進展、企業合作、併購、融資的新聞層出不窮。 CTLA-4、PD-1、PD-L1這些熱門靶點也頻繁被業界媒體提及。
其實,腫瘤免疫治療從1891年紐約一名外科醫生William Coley用細菌來治療腫瘤的試驗開始,經歷了漫長的探索,遭遇重大挫折。直到1984年,美國國立癌症研究院史蒂夫•羅森伯格(Steve Rosenberg)團隊成功地用高劑量白細胞介素2(IL-2)治愈第一例病人,給腫瘤免疫治療帶來一線曙光。此後,新技術新治療方案包括單克隆抗體、腫瘤疫苗不斷湧現,雖然對一些病人和適應症有效,但沒能被大規模應用。 30年後,讓這個領域揚眉吐氣的是兩類治療途徑:一種是針對免疫檢驗點的抗體;另一種是表達嵌合抗原受體的自體T細胞療法。
免疫檢驗點抗體是通過激活病人自身免疫系統中的T細胞來消滅腫瘤細胞(見圖1:免疫檢驗點共信號機制和圖2:免疫檢驗點抗體作用機理)。 CTLA-4單抗Ipilimumab是唯一被批准上市的免疫檢驗點抑製劑。該抗體由Medarex公司發現,授權百時美施貴寶開發,在惡性黑色素腫瘤患者上取得顯著生存獲益,於2011年在美國批准上市。另一個CTLA-4單抗tremelimumab也是由Medarex公司發現,經輝瑞開發,又轉讓給阿斯利康繼續開發。針對PD-1和PD-L1的單抗有多家公司開發,競爭十分激烈。目前,在後期臨床試驗的有nivolumab(PD-1)、lambrolizumab(PD-1)和MPDL3280A(PD-L1)。其他針對OX40、4-1BB的多個單抗在早期開發中。與此同時,CTLA-4和PD-1單抗的聯合治療試驗也在進行,並取得階段性成果。過去3年,ASCO(美國臨床腫瘤協會)年會上,免疫檢驗點抑製劑單抗臨床試驗數據發布都是令人矚目的亮點。預計今後幾年內會有多個免疫檢驗點抗體上市,適應症也會擴充到其他腫瘤類型。
圖1 免疫檢驗點共信號機制
T細胞的激活依靠“雙信號”細緻地調控。一個激活信號是MHC(主要組織相容性複合體)-TCR(T細胞受體)的結合。另一個來自共刺激分子(OX40,4-1BB)和共抑制分子(CTLA-4.PD-L1.PD-1)的信號傳遞,好比是汽車的“油門”或“剎車”。
圖2 免疫檢驗點抗體作用機理
肿瘤细胞入侵后,会压制T-细胞激活,从而逃脱免疫系统的围剿。如果我们能用针对OX40、4-1BB的激活剂单抗来“猛踩油门”,或针对CTLA-4、PD-1/PD-L1的拮抗剂单抗来“松开刹车”,T细胞都可以摆脱肿瘤细胞的压制,重新被激活来识别杀伤肿瘤细胞。
研發領域跌宕起伏
嵌合抗原受體T細胞療法(CAR)是運用病人自體T細胞的個性化治療方法。其臨床試驗由幾個美國研究機構主導。根據這些試驗結果,CAR在其他治療方法無效的淋巴癌患者身上有效率很高。對部分病人,血液腫瘤在幾天內溶解消失。當然,CAR製備過程的複雜性對臨床試驗的規模是一個限制,所以現在病例數與免疫檢驗點抗體相比要少很多,且主要局限於表達CD19抗原的腫瘤(見圖3:嵌合抗原受體CAR自體T細胞療法)。
圖3 嵌合抗原受體CAR自體T細胞療法
嵌合抗原受體(CAR)是一種個性化的治療方法。病人的T細胞通過基因工程修飾,加上一個嵌合蛋白。經過嵌合蛋白修飾的T細胞彷彿帶上了一個“嚮導”,能像巡航導彈一樣,識別攻擊帶有CD19抗原的腫瘤細胞並引發免疫反應。
腫瘤免疫療法是一個廣大領域。除了免疫檢驗點抗體、CAR捷報頻傳之外,還有其他途徑,比如腫瘤疫苗。 2010年美國批准上市的Sipuleucel-T是一種針對前列腺癌的自體樹突狀細胞疫苗,也是第一個被批准上市的治療性腫瘤疫苗。這個產品在上市時給業界帶來很高期望。可惜在市場上表現差強人意。 2014年3月17日,溶瘤病毒疫苗OncoVex在惡性黑色素瘤患者的Ⅲ期試驗階段性結果公佈,數據不錯。 3天之後,MAGE-A3抗原疫苗的針對非小細胞肺癌的大型Ⅲ期試驗沒有到達預期效果。 4月4日,OncoVex Ⅲ期試驗的正式結果公佈,達到了主要終點,但次要終點OS總生存期沒有達到,可謂一波三折。這種跌宕起伏充分反映了我們對腫瘤疫苗分子細胞水平上機制的了解依然十分有限,該領域潛力和研發風險巨大,對以後的腫瘤疫苗研發有很多啟發。
革命性醫藥技術的發展往往是一個在黑暗中摸索的過程,需要科學家持續的努力和不斷的調整,輸贏不在起跑線上。以CTLA-4單抗為例,tremelimumab的臨床試驗與ipilimumab並駕齊驅,本來有機會成為第一個被批准的免疫檢驗點抗體,但可惜因多種因素,一線治療的Ⅲ期試驗意外提前中止。 Ipilimumab後來居上,是汲取了tremelimumab的教訓,在臨床試驗方案上作了改進。
CAR技術自1989年起,經過三代演進:第一代只有T細胞刺激因子,沒有共刺激因子;第二代只有單個共刺激因子;第三代才有兩個共刺激因子。這些改進都是基於一系列臨床試驗,對CAR的有效性有顯著提高。 (如下圖所示)
圖4 嵌合抗原受體CAR的演化
三代CAR技術的演化反映了共刺激分子的重要作用
從更宏觀的角度來看,CAR是腫瘤過繼細胞轉移治療的一種。其他的療法還有腫瘤浸潤性淋巴細胞(TIL)和T細胞受體(TCR)等等。這些療法都在早期試驗階段,尚有大量未知因素。 CAR的成功是免疫學家集思廣益,不斷試錯的結晶。
中國古人說:“失敗是成功之母”,用在腫瘤免疫的案例上是再恰當不過了。
試驗設計的思維框架
腫瘤免疫治療不但對一部分病人療效顯著,而且對該類新藥臨床試驗方案設計與安全性評估都帶來新的範式(Paradigm)和思維框架。
首先,傳統的臨床試驗終點依賴在不同藥劑量下對腫瘤大小的評估,假設腫瘤體積的變化趨勢是單一的。在免疫檢驗點單抗的臨床試驗中,有一部分病人的腫瘤體積在前幾個月會變大,藥物的療效要幾個月後才能逐漸顯現,然後腫瘤體積再逐漸變小,得到控制。所以該類新藥的臨床試驗方案設計需要考慮到這些新的變數,以最優化的療程、終點與統計學方法來測試新藥的療效。
其次,在免疫檢驗點單抗的臨床試驗中,應答率並不高。但對小部分有療效的病人,藥物的作用往往可以持續一年到幾年的時間。在ipilimumab的長期試驗中,1861個黑色素瘤病人中,22%存活3年,17%存活7年或更長時間。這與腫瘤小分子靶向藥物有不少區別。在賓州大學CAR的首次臨床試驗中只有3個病人,都有療效,兩個病人症狀完全緩解。
一個很關鍵的、懸而未解的問題,是怎樣運用生物標記物依照個性化醫療的原理來挑選最合適接受腫瘤免疫治療的病人。這是我從事轉化科學研究的同事和同行們都很關注的。
最後,腫瘤免疫治療雖然避免了一些傳統腫瘤藥物的毒性,但帶來新的安全性的挑戰。 CAR會引起急性不良反應(包括發燒、低血壓和極度疲乏)。免疫檢驗點單抗也可能引起自身免疫系統相關的嚴重不良反應(例如大腸炎和下垂體炎等),甚至死亡。
2014年4月9日,紀念斯隆-凱特琳癌症中心基於安全性原因,暫停了一個CAR臨床試驗的病人入組。時值美國腫瘤研究協會AACR年會期間,這個決定引起了業界高度關注。怎樣理解這些不良反應的成因並製訂相應的安全性評價標準與臨床試驗方案也是業界的當務之急。
來自亞洲科學家的貢獻
腫瘤免疫治療的大量早期研究與臨床試驗是由美國大學科研機構、小型生物科技公司和大型藥企來主導。來自亞洲的科學家們作出了特別突出的貢獻。 PD-1由日本京都大學本庶佑教授於1992年發現。日本藥廠小野製藥與Medarex公司自2005年合作開發PD-1。
PD-L1由中國科學家陳列平(Lieping Chen)教授於1999年發現。他現任美國耶魯大學醫學院免疫生物學和醫學系教授、耶魯癌症中心腫瘤免疫學主任。他的實驗室對免疫檢驗點的共刺激機製作出一系列重要發現,包括PD-L1和4-1BB等。
劉勇軍(Yong Jun Liu)博士是世界著名免疫學家。在過去20年間,在免疫應答、發育、樹突狀細胞與新型疫苗等多個領域有開創性的發現,在國際期刊上發表了超過230篇文章。在擔任美國MD安德森癌症中心免疫系系主任時,劉勇軍博士首次發現刺激OX40可以阻止腫瘤內免疫抑制性T細胞功能(Treg),並研發了針對OX40的人源化抗體。 2012年底,該抗體以超過3.3億美元的金額(包括里程金)通過許可證轉讓給葛蘭素史克。這是MD安德森癌症中心有史以來最大的對製藥業的技術轉讓。劉勇軍博士2014年1月加入阿斯利康下屬位於美國馬里蘭州MedImmune生物製藥研發部,擔任資深副總裁。我今年2月去美國出差,有機會與他見面,對他的學識與遠見十分敬佩。
陳列平和劉勇軍這兩位免疫學界的世界級頂尖科學家,不但是學術、工業界的兩棲人才,還有醫學、基礎科學的雙重學術訓練,更有中美歐文化背景。他們可以將實驗室的發現與臨床研究連接起來,以整體視角探索科學前沿和新藥發現。
風投併購頻仍
腫瘤免疫治療臨床試驗的一系列成功,不但激勵了科學家,對美國風險投資人、創業者、生物科技公司及跨國藥企的戰略有深遠的影響。
近幾年來,這個領域成為投資併購合作的大熱點。 2009年,百時美施貴寶以24億美元收購Medarex公司。 2012年,諾華與賓州大學合作,取得CAR知識產權,斥資2000萬美元在賓大校園建立一個專門的研發中心。 2013年,阿斯利康MedImmune部門以5億美元收購Amplimmune公司。專注於CAR技術的創業公司Juno Therapeutics接受1.45億美元的A輪融資。 2014年1月,阿斯利康與Immunocore公司就ImmTAC技術合作,里程金總額達3億美元。 2月,默沙東與Ablynx公司就免疫檢驗點納米抗體技術合作,里程金總額達23億美元。 3月,百時美施貴寶與Five Prime公司就腫瘤免疫檢驗點通路的新靶點合作,里程金總數3億美元。
花旗銀行分析師認為,腫瘤免疫治療在10年內有潛力成為一個350億美元的市場。這是基於一系列樂觀的假設:適應症擴大到主要癌症種類,聯合治療能支持高昂價格模式並擴展適應症,及延長治療週期。
在中國,2014年3月18日國家衛計委在啟動重大新藥創制科技重大專項2015年度課題申報工作的通知中,明確將PD-1、PD-L1和CTLA-4列為腫瘤免疫重要新靶點。
阿斯利康首席執行官Pascal
Soriot上任後,將腫瘤定為三大核心疾病領域之一,腫瘤免疫治療成為公司的戰略重點。通過MedImmune生物製藥研發部,腫瘤免疫產品管線包括tremelimumab(CTLA-4)、MEDI4736(PD-L1)、MEDI6469 (mOX40)和從Amplimmune收購的PD-1抗體(AMP514)。這些針對不同靶點的抗體為聯合治療提供了各種可能性。同時,阿斯利康創新醫藥部也有富有潛力的小分子腫瘤新藥進展迅速,提供了更多抗體與小分子不同機制聯合治療的可能性。劉勇軍博士的加盟與陳列平教授的指導無疑會讓阿斯利康在腫瘤免疫治療領域的科學領導力更進一步。
軍人琳達的故事
1984年11月,美國國立癌症研究院。琳達•泰勒因晚期轉移性黑色素瘤參加了一項由史蒂夫•羅森伯格博士主持的用IL-2進行腫瘤免疫治療的臨床試驗。在她之前,已有80個病人參加試驗,沒有一人存活。面對癌症的挑戰,羅森伯格博士決定大幅度增加劑量。琳達當時在美國海軍服役,從事文秘工作。她勇敢地克服了種種毒副作用,堅持完成了一個月的治療出院。她的病情逐漸穩定,最後體內腫瘤完全消失。
奇蹟發生了。琳達成為第一個由腫瘤免疫療法治癒的病人,也是現代腫瘤學的一個歷史見證人。琳達從死亡邊緣回來,決定繼續服役。她取得了工商管理碩士等3個碩士學位,擔任一系列指揮工作。她軍功卓著,24年後以海軍上校軍銜退休。 2013年12月,琳達回到國立癌症研究院,與羅森伯格博士重逢。他們共同參與拍攝一部有關癌症歷史的大型紀錄片,向世界分享這個時間跨度近30年的故事。
1985年,羅森伯格博士成為《新聞周刊》封面人物。他用IL-2進行腫瘤免疫治療的臨床試驗結果在《新英格蘭醫學雜誌》發表。在文章摘要的結尾,他謹慎地寫道:“在對該(白細胞介素2腫瘤免疫)治療的價值下結論之前,我們需要對這種治療方法進一步開發和對病人進行跟踪。”
30年後,腫瘤免疫療法再次強勢回歸公眾視野,在更多病人身上獲得顯著療效。 2014年ASCO將在5月底召開,大量腫瘤免疫治療的最新臨床試驗結果即將發布,讓我們一同見證更多奇蹟。
備註:本文作者為楊青博士(steve_yang@wuxiapptec.com),楊青在過去3年多里擔任阿斯利康亞洲及新興市場創新醫藥研發副總裁。 4月15日,他加入藥明康德擔任執行副總裁和首席運營官。楊青是百華協會(BayHelix)共同創始人之一,也是藥物信息協會(DIA)中國顧問委員會成員。本文寫作是他在阿斯利康任內完成。
作者: 夺标 时间: 2016-5-1 13:16
肿瘤免疫治疗是应用免疫学原理和方法,提高肿瘤细胞的免疫原性和对效应细胞杀伤的敏感性,激发和增强机体抗肿瘤免疫应答,并应用免疫细胞和效应分子输注宿主体内,协同机体免疫系统杀伤肿瘤、抑制肿瘤生长。[1] 肿瘤免疫治疗近来备受关注,是肿瘤治疗领域的焦点。近几年,肿瘤免疫治疗的好消息不断,目前已在一些肿瘤类型如黑色素瘤,非小细胞肺癌等的治疗中展示出了强大的抗肿瘤活性,并已有肿瘤免疫治疗药物获得美国FDA(Food and Drug Administration, FDA)批准临床应用。肿瘤免疫治疗由于其卓越的疗效和创新性,在2013年被《科学》杂志评为年度最重要的科学突破。[2] 肿瘤免疫治疗有望成为继手术,化疗,放疗,靶向治疗后肿瘤治疗领域的一场革新。
目录
1 肿瘤免疫治疗的历史
2 肿瘤疫苗
3 CAR-T细胞疗法
4 单克隆抗体类免疫检查点抑制
5 小分子抑制剂
肿瘤免疫治疗肿瘤免疫治疗的历史
虽然肿瘤免疫治疗是目前肿瘤领域的研发热点,但肿瘤免疫治疗并不是新鲜话题。几乎早在100多年前免疫学创建之初,科学家就提出了利用机体自身免疫功能去攻击肿瘤细胞消灭肿瘤的设想,并进行了各种尝试。[3] 1950s年代Burnet和Thomas提出了“免疫监视”理论,认为机体中经常会出现的突变的肿瘤细胞可被免疫系统所识别而清除,为肿瘤免疫治疗奠定了理论基础。[4] 随后,各种肿瘤免疫疗法包括细胞因子疗法,过继免疫疗法(如淋巴因子激活的杀伤细胞)相继临床应用。2003年发表于《新英格兰医学杂志》的一项研究发现,肿瘤浸润T细胞数量与宫颈癌患者的总生存期及无进展生存期相关[5] ,证实了肿瘤特异性T细胞的存在,表明免疫系统是可以识别肿瘤并试图控制其生长的。2010年美国FDA批准了人类历史上第一支用于前列腺癌的治疗性肿瘤疫苗sipuleucel-T(商品名:PROVENGE)。然而,直到2011年,第一支用于免疫检查点抑制的单抗(anti-CTLA-4单抗,Ipilimumab) 被美国FDA批准用于晚期黑色素瘤的二线治疗,标志着肿瘤免疫治疗进入了新时代。最近,已有多个肿瘤免疫治疗药物被美国FDA批准应用于临床,包括Ipilimumab(商品名:YERVOY),Pembrolizumab(anti-PD-1单抗,商品名:KEYTRUDA),Nivolumab(anti-PD-1单抗,OPDIVOÔ)获批用于晚期黑色素瘤。在2015年3月4日,Nivolumab被美国FDA批准用于晚期鳞状非小细胞肺癌的二线治疗。
肿瘤免疫治疗肿瘤疫苗
肿瘤疫苗[6] ,是利用疫苗引发特异性抗肿瘤T细胞反应,从而消灭肿瘤的一种治疗性疫苗。肿瘤疫苗主要包括:肿瘤抗原肽段疫苗,人工合成肿瘤抗原肽段,单独或者与佐剂一起输注入患者体内,通过这些肿瘤抗原肽段来激发机体特异性抗肿瘤免疫反应;树突状细胞疫苗,初始T细胞不能直接识别肿瘤抗原,必须由抗原呈递细胞摄取肿瘤细胞释放的肿瘤抗原,并在细胞内加工处理成肽段,再与MHC分子结合形成“抗原肽-MHC复合物”呈递到细胞表面,才能被初始T细胞识别。通常主要的抗原呈递细胞就是树突状细胞。树突状细胞疫苗,就是将患者体内树突状细胞的前体细胞分离出来,在体外培养,并使之负载肿瘤抗原肽段,然后回输到患者体内,继而通过树突状细胞激发特异性抗肿瘤T细胞反应。2010年美国FDA批准的人类历史上第一支用于前列腺癌的治疗性肿瘤疫苗sipuleucel-T(商品名:PROVENGE),就是树突状细胞疫苗;溶瘤病毒疫苗,将基因工程改造的溶瘤病毒注射入肿瘤内,溶瘤病毒感染肿瘤细胞,病毒不断复制导致肿瘤细胞溶解,同时释放增强免疫反应的细胞因子,从而“一箭双雕”,杀伤肿瘤。
肿瘤免疫治疗CAR-T细胞疗法
免疫学界的一种思路就是把肿瘤病人的T细胞活化后回输给病人,利用这些活化的T细胞识别并杀伤肿瘤细胞。但是,有些肿瘤,尤其是非实体瘤,免疫原性较弱,或者很难收集到肿瘤特异性较强的T细胞。于是,免疫学家就从患者自身血液收集T细胞,收集之后对T细胞进行基因工程处理,从而在其表面表达能够识别特异性肿瘤抗原的特殊受体,这种受体被称为嵌合抗原受体(chimeric antigen receptor, CAR),同时在受体的胞内段加上引起T细胞活化的信号传递区域。CAR是一种蛋白质受体,可使T细胞识别肿瘤细胞表面的特定蛋白质(抗原),表达CAR的T细胞可识别并结合肿瘤抗原,进而攻击肿瘤细胞。这种表达CAR的T细胞被称为CAR-T。经过设计的CAR-T细胞可在实验室培养生长,达到数十亿之多将扩增后的CAR-T细胞注入到患者体内,注入之后的T细胞也会在患者体内增殖,并杀死具有相应特异性抗原的肿瘤细胞。[7]
到目前为止这种方法仅限于小规模临床试验,这些经过设计的免疫细胞治疗晚期血液肿瘤患者已产生一些显著疗效,并且正在尝试用于实体瘤。虽然这些初步结果令人鼓舞,但是CAR-T细胞疗法还有许多方面有待研究,如独特的副作用,细胞因子释放综合症等。
肿瘤免疫治疗单克隆抗体类免疫检查点抑制
1. Anti-CTLA-4单抗
细胞毒性T淋巴细胞抗原4(cytotoxic T-lymphocyte antigen 4, CTLA-4)又名CD152,是由CTLA-4基因编码的一种跨膜蛋白,表达于活化的CD4和CD8 T细胞。CTLA-4和CD28均为免疫球蛋白超家族成员,具有高度同源性,二者与相同的配体B7-2(CD86)和B7-1(CD80)结合。与CD28功能相反,CTLA-4与其配体B7分子结合后后产生抑制性信号,抑制T细胞激活,是免疫系统一个至关重要的 “刹车”。CTLA-4是使肿瘤细胞免受T细胞攻击的一个重要机制。因此阻断CTLA-4的免疫效应可刺激免疫细胞活化,大量增殖,从而诱导或增强抗肿瘤免疫反应。[7]
目前两种靶向CTLA-4的抗体Ipilimumab和Tremelimumab在黑色素瘤、肾癌、前列腺癌、肺癌等的临床研究已广发开展。1/2期临床研究结果显示两种抗体无论是抗体单药还是联合IL-2,gp100疫苗或化疗均显示安全有效。
Ipilimumab是全人源化单抗,已被美国FDA批准用于晚期黑色素瘤。在肺癌治疗中的Ⅱ/Ⅲ期临床试验也迅速开展。Tremelimumab也是一种人源化CTLA-4单抗,是一种IgG2抗体,目前在多种肿瘤中的临床试验正在进行中。
2. Anti-PD-1/PD-L1单抗
程序性死亡受体1(programmed death 1, PD-1)为CD28超家族成员。 PD-1表达于活化的T细胞,B细胞及髓系细胞,其有两个配体,即程序性死亡配体-1(programmed death ligand 1, PD-L1)和PD-L2。PD-L1/L2在抗原递呈细胞都表达,PD-L1在多种组织也有表达。PD-1与PD-L1的结合介导T细胞活化的共抑制信号,调节T细胞活化和增殖,起到类似于CTLA-4的负调节作用。华裔科学家陈列平实验室首先发现PD-L1在肿瘤组织高表达,而且调节肿瘤浸润CD8 T细胞的功能。因此,以PD-1/PD-L1为靶点的免疫调节对抗肿瘤有重要的意义。[8]
近年来,已有多种Anti-PD-1/PD-L1抗体在肿瘤免疫治疗的临床研究迅速开展。目前Pembrolizumab和Nivolumab已被FDA批准用于晚期黑色素瘤,最近Nivolumab也已被美国FDA批准用于晚期鳞状非小细胞肺癌的治疗。另外,MPDL3280A (anti-PD-L1单抗),Avelumab(anti-PD-L1单抗)等也已进入多个晚期临床研究中,覆盖非小细胞癌,黑色素瘤,膀胱癌等多个瘤种。
3. 其它类型单克隆抗体
其它如增强T细胞第二信号从而促进肿瘤特异性T细胞活化和增值的单抗类,如肿瘤坏死因子TNF受体家族的OX40和4-1BB单抗也在研发中。
肿瘤免疫治疗小分子抑制剂
IDO抑制剂
肿瘤微环境中有许多免疫抑制分子存在,通过调节这些抑制分子的功能进而改善肿瘤免疫微环境的免疫治疗策略也受到了重视。吲哚胺-(2,3)-双加氧酶(Indoleamine 2,3-dioxygenase, IDO)是由IDO1基因编码的酶类,是将必须氨基酸色氨酸降解为犬尿氨酸的限速酶,犬尿酸可直接抑制效应T细胞的功能,同时微环境中色氨酸耗竭也会抑制T细胞增殖,从而通过多途径发挥免疫抑制的作用。[9] 很多肿瘤高表达IDO从而逃避T细胞的攻击。因此,IDO抑制剂能调节肿瘤微环境的色氨酸含量,避免肿瘤微环境中T细胞增殖受抑制,成为潜在的免疫治疗靶点。目前,已有IDO抑制剂(INCB024360)联合Pembrolizumab的Ⅰ/Ⅱ期临床研究在进行中,评估其在晚期非小细胞肺癌中的疗效和安全性。
参考资料
1. 周光炎主编. 免疫学原理. 上海. 上海科学技术出版社. 2014年第3版
2. Science 2013;342:1435-41
3. Ehrlich P Ned Tijdschr Geneeskd 1909;5:273-90
4. Burnet FM. Lancet,1967;1:1171-4
5. Zhang L, et al. N Engl J Med 2003;348:203-13
6. Mellman I, et al. Nature 2011;480:480-9
7. Lee DW, et al. Clin Cancer Res 2012;18:2780-90
8. Chen DS, et al. Immunity 2013;39:1-10
9. Lob S, et al. Nat Rev Cancer 2009;9:445-52
作者: 夺标 时间: 2016-5-1 13:17
癌症治療的最新進展–免疫檢查點療法
文/駱宛琳
不久前,號稱東方諾貝爾獎的唐獎 (Tang Prize)在生技醫藥領域,頒給致力於癌症免疫治療的詹姆斯•艾利森(James Allison)博士和本庶佑(Tasuku Honjo)博士。而最新一期的《自然》期刊,更是一連刊了五篇癌症免疫治療相關研究的最新突破[1-5]。2014年即將進入尾聲,而在癌症治療上,則發布了個振奮人心的好消息!
什麼是癌症免疫療法(Cancer Immunotherapy)呢?簡單來說,就是利用病人本身的免疫反應機制來對抗癌細胞。我們的免疫細胞除了抵抗外來病毒、病原菌,平時也到處巡邏確保身體內我們自己的細胞沒有病變成不正常的細胞。而這種「檢查哨」的角色,必須經過嚴密調控,以防止免疫細胞不會錯亂並攻擊正常細胞,造成正常組織損傷或誘發自體免疫疾病。對免疫細胞來說,腫瘤內的「微環境」通常都不太利於活化免疫細胞,使得腫瘤內部常處在偏向免疫抑制的狀態。癌症免疫療法就是希望能透過各種已知使免疫細胞反應更活躍的方法,重新活化免疫細胞,讓免疫細胞能成功辨識並殺死腫瘤細胞[6, 7]。
類似癌症免疫療法的構想可以追溯到1910年代由William Coley醫師所提出來的假說[6, 8]。Coley醫師認為手術後的癌症患者,如果併發細菌感染,可以降低癌症復發的機率。Coley醫師在病患腫瘤內注入高溫殺死的細菌,希望藉由激發病患的自體免疫反應來控制腫瘤,注射後,部分病患身上可觀察到腫瘤逐漸消失了[6, 8]。如今,科學家對於免疫反應機制有更深層的瞭解,也發展出許多促進或活化免疫系統,以對抗癌症細胞的治療策略。其中一種眾所矚目的治療方法,就是艾利森博士及本庶佑博士所研究的「免疫檢查點療法」(checkpoint blockade)[6, 7]。
[color=rgb(28, 97, 173) !important]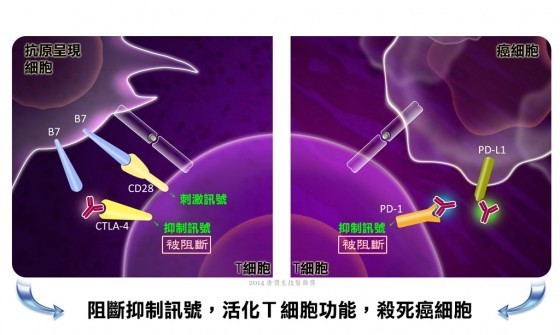
免疫檢查點療法的原理,圖片來源:唐獎網站
癌症細胞能夠誘使免疫細胞啟動「抑制免疫反應」的訊息傳導,而免疫檢查點療法是透過阻斷這些「抑制免疫反應」的訊息傳導,使免疫細胞即使在腫瘤內部(不利免疫細胞發揮功能的環境)也能夠被活化,完成消滅腫瘤細胞的任務。主要的治療靶點,是CTLA-4和PD-1這兩個表現在T細胞表面的免疫抑制受體[6, 7]。當CTLA-4和PD-1與各自的配體結合時,抑制T細胞免疫反應的訊息傳導會被啟動,於是T細胞的功能與活動力會因此降低。以PD-1受體來說,很多腫瘤細胞會表現其配體PD-L1,當PD-L1和PD-1結合後,表現PD-1的T細胞會因此死亡。目前阻斷PD-1或CTLA-4功能的抗體已由美國FDA核准為治療癌症的試驗用新藥。在臨床治療上,許多使用後的病患也能穩定控制病情。但是,免疫檢查點療法並非期待免疫系統將癌細胞趕盡殺絕,科學家也沒有誇下海口說這樣的治療策略能夠完全「治癒癌症」。或許對於治療癌症而言,我們也許並不是需要真正的「治癒」,而是透過免疫系統的監控,讓癌細胞對正常生理與病患日常生活的影響力降到最低,變成能和平共處的慢性病。
另外,免疫檢查點療法目前僅發現在特定的癌症與部分病人上有顯著的療效,約有半數的腎臟癌、肺癌,和黑色素細胞癌之病例,證實使用該方法能夠延長病患的生命。但在最新一期的《自然》期刊上所發表的五篇相關論文,除應用免疫檢查點療法於不同癌症上,也找出部分病人在接受治療後有良好反應的主要原因。
Antoni Ribas博士的研究團隊發現,對免疫檢查點療法有明顯反應的病患,在治療前,腫瘤周圍會聚集較多的CD8+ T細胞(一種可以直接殺死目標細胞的T細胞), 而且PD-1與PD-L1 的表現較高[3]。以直觀來說,腫瘤內PD-L1表現特別高的病人,理當會對阻斷PD-1訊息傳導途徑的抗體治療反應較明顯。但是,Ribas的研究團隊認為,關鍵不僅是腫瘤內癌細胞PD-L1的表現量,在治療前腫瘤邊緣所聚集的CD8+ T細胞數量,與這些細胞所表現的PD-1與PD-L1也相當重要。於是Ribas研究團隊的發現,可提供另一種方式評估臨床上病患是否適合接受免疫檢查點療法。
而分別由Nicholas Vogelzang與Stephen Hodi所主導的兩個團隊,發現透過抗體阻斷PD-L1(目前所用的抗體為阻斷PD-1)的功能,能應用於多種不同癌症,而且目前臨床實驗中觀察到的副作用也較低於原本的免疫檢查點療法 [1, 2]。另一方面,Robert Schreiber與Lelia Delamarre的研究團隊則分析癌細胞所表達的癌細胞抗原[4, 5],發現癌細胞所表現的特殊抗原,不一定來自與腫瘤疾病進程有關的基因。
這些關於癌症免疫治療最新研究,不僅為癌症病患捎來了好消息,也在癌症醫療上建立了新的里程碑。
參考資料:
- Powles, T. et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature (2014) 515, 558–562.
- Herbst, R. S. et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature (2014) 515, 563–567.
- Tumeh, P. C. et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature (2014) 515, 568–571.
- Yadav, M. et al. Predicting immunogenic tumour mutations by combining mass spectrometry and exome sequencing. Nature (2014) 515, 572–576.
- Gubin, M. M. et al. Checkpoint blockade cancer immunotherapy targets tumour-specific mutant antigens. Nature (2014) 515, 577–581
- Coley, W. The Treatment of Inoperable Sarcoma by Bacterial Toxins (the Mixed Toxins of the Streptococcus erysipelas and the Bacillus prodigiosus). Proc R Soc Med. (1910); 3(Surg Sect): 1–48.
- Wolchok, J. et al. Cancer: Antitumour immunity gets a boost. Nature (2014) 515, 496–498
- Leslie, M. Multiple boosts for cancer immunotherapy. Science (2014) Latest News.
作者: 夺标 时间: 2016-5-1 13:18
谁是近20年癌症治疗贡献重大的华人科学家?
英国小说家阿道司·赫胥黎( Aldous Huxley )曾说过:“越伟大、越有独创精神的人越喜欢孤独。”不过对大多数学者来说,他们会将孤独拒之门外,并害怕被其他人孤立起来,能否进入主流学术圈被其视为学术成功与否的标准之一。自然而然,这些学者也甘愿在主流学术圈里埋没自己的天赋,亦步亦趋,一生鲜有独特的科学发现。
耶鲁大学教授、威廉·科利奖( William B. Coley Award )得主陈列平却持有截然不同的观点,“我不会成为一名主流科学家,如果有人说我是主流科学家,我倒要好好反思,重新审视一下自己,因为成为所谓的‘主流’科学家意味着我发现新事物的能力已下降,所以当大家在做主流的科学研究时,我会另辟蹊径,设定新目标,寻找新的东西”。三十多年的学术生涯,是陈列平这一理念的生动诠释。他自称是个“孤独的探索者”,但乐在其中。
掀开肿瘤免疫治疗的新篇章
早在上世纪90年代,陈列平的实验室就揭示了肿瘤在生长过程中抑制免疫反应的主要机制并鉴定了关键分子——PD-L1 受体,从而为抗 PD-1/PD-L1 药物的研发打下坚实的基础。
高中时代的陈列平,是篮球田径的好手,他对体育运动的兴趣一直保持到现在。对数学的浓厚兴趣,曾一度让他理想成为“一名高中数学老师”,从没想过成为医生或从事医学研究。1977 年恢复高考后,他从插队的农村考进福建医科大学学医,用他的话来说“这是意外"。
大学毕业之后, 陈列平做过一段时间的临床医生并考入北京协和医学院,研究免疫学。1986 年他来美国攻读实验病理学博士学位和从事博士后研究,结业后并没有立即进入学术界,而是在制药公司百时美施贵宝(Bristol-Myers Squibb)从事基础和肿瘤免疫学研究以及药物研发工作。
但 1997 年,他面临着一个艰难的抉择:百时美施贵宝关闭了公司整个肿瘤免疫治疗研发部门,如果他选择留下,得放弃原先的研究,从事小分子药物的研发。当时肿瘤靶向药物的研发是肿瘤治疗的主流方向,如日中天,成为各大制药公司的宠儿,肿瘤免疫治疗的曙光暂未出现,被冷落一旁。
陈列平毅然离开了百时美施贵宝,到梅奥医疗中心(Mayo Clinic)建立一个新的实验室,之后又搬到约翰霍普金斯医学院(Johns Hopkins School of Medicine)。在这段时间里,他的实验室终于揭示了肿瘤在生长过程中抑制免疫反应的主要机制并鉴定了关键分子,从而为抗 PD-1/PD-L1 药物的研发打下坚实的基础。
从免疫学诞生之日起,其就是一门基础理论和临床应用并行的科学。早在 20 世纪 50 年代,科学家就发现人体的免疫系统可对生长的肿瘤产生反应,并可抑制其生长。这些反应具体表现是,在肿瘤中常常可以看到大量的淋巴细胞存在(或浸润),并且在病人血液中也可分离到有能力杀死肿瘤的淋巴细胞。
然而令科学家困惑的是,这些免疫反应在绝大多数情况下无法扼制肿瘤生长。这就形成了一种奇特的现象: “你打你的, 我长我的”,这种现象被称之为“肿瘤免疫逃逸”。近几十年的临床实践也证明,肿瘤免疫逃逸是绝大多数免疫治疗失败的重要原因,阐明肿瘤免疫逃逸的分子机制不仅仅是肿瘤免疫学的理论问题,还和临床肿瘤治疗密切相关。因为当时肿瘤免疫逃逸的关键机制不清楚,免疫学的主流研究集中在用增强免疫反应的办法来克服肿瘤免疫逃逸,包括肿瘤疫苗、细胞因子、转输细胞治疗、去除调节淋巴细胞等。
上世纪90年代早期,陈列平就提出肿瘤微环境中存在免疫逃逸关键分子的假设,并集中力量鉴定这类分子。1999 年到 2002 年间,陈列平和他的团队率先发现肿瘤微环境中,特别是肿瘤细胞上过度产生一个免疫球蛋白样的分子,将其命名为 B7-H1(现在又称 PD-L1),并证明此分子的过度表达,选择性地抑制了肿瘤微环境中淋巴细胞的免疫反应。他的实验室还和其他实验室共同发现 B7-H1 (PD-L1) 通过结合 PD-1 对免疫细胞的激活起抑制作用。
根据这些发现,陈列平及其团队首先发明用单克隆抗体阻断 PD-1/PD-L1 的结合,发现其在小鼠模型中可抑制肿瘤生长,这为抗 PD-1/PD-L1 抗体药物的临床研究奠定了坚实的基础。受到这些发现的鼓舞,2006 年,他在约翰霍普金斯医院发起并帮助组织了第一个抗体治疗的临床实验,由此掀开了肿瘤免疫治疗一个划时代的篇章。现在,PD-1/PD-L1 抗体被誉为“肿瘤治疗抗生素”。
孤独的科学探索者
“你要想在一个领域里有所成就,就不要过于考虑别人对你的评价。作为一名研究人员,不要老想进入主流科学,因为一旦成为‘主流科学家’,那说明你的创新能力可有问题了。"
十余年弹指一挥间,夹杂着挫折、艰辛与成就,陈列平已是肿瘤免疫治疗领域的开路先锋。是何种动力在激励着他卓尔不群?陈列平回忆起 1989 年博士即将毕业,他的导师 Frederick Earle Wheelock 曾对他讲过的一席话。
“Wheelock 教授对我说,一个领域的科学家,能独立思考、独立做出重大发现的只占 5%,另外有5%是不合格的科学家,他们的思路有问题,随时可能被淘汰,而绝大多数的科学家属于中间的那部分,他们不断地跟踪前面 5% 科学家做出的发现,但平时他们会打击两边的 5%,他们既瞧不起底下 5% 的科学家,又在大多数时候对前面 5% 的科学家不屑一顾,因为这些科学家的新发现暂未出现。‘我知道你终有一天会独立研究,你如何选择:是前面的5%,中间的 90%,还是后面的 5%?’”
尽管 20 多年过去了,陈列平对这句话仍铭记于心。他认为,“要成为前面5%的科学家,需要毅力,对来自主流领域的冷嘲热讽、不支持、不予以奖励,要有良好的心态处之”。如今细数起来,他的研究经历也在诠释着前面5%的科学家会有哪些不同的境遇。
由于肿瘤疫苗在临床治疗的失败,该领域在 2000 年初处于低潮中。2006 年, 经过了多年的艰辛筹备,抗 PD-1/PD-L1 抗体药物在美国开始了I期临床试验。两年之后,I期临床结果喜人,陈列平就回国,跟国内同行交流这方面的研究,但当时很多学者并没有听过这方面的研究,实际上也不关心。
有学者甚至反对他,认为“这项研究样本数量太少,纵然实验结果不错,但是范围太小”。还有些学者抱有谨慎的乐观,认为“这个临床实验只是运气比较好"。原本陈列平打算在国内尝试开展类似的研究,然而国内学术界对此项研究反应冷淡,从他实验室回国的博士后也在经费申请上遇到很大挑战。在肿瘤免疫治疗领域,中国失去了一次赶超世界水平的机会。
2012 年,抗 PD-1 药物 I/II 期临床试验结束,结果显示抗 PD-1 药物对肿瘤治疗效果非常明显。彼时广东省召集国内外学者回国进行大型科学项目转化研究,于是陈列平回国组建创新团队,打算试一试。“当时我希望从基础研究、转化医学到临床研究,把美国的经验放到中国来"。
然而十多个评委中一半以上都是院士,并没有认可这项工作的重要性,结果是申请的经费被砍掉了 90% 。受挫之后,陈列平来到了福建,希望当地政府和母校能支持他的研究工作,好在最后他在这里获得了支持。目前陈列平在国内的实验室已建立起来,主要从事转化医学、临床研究和肿瘤免疫药物开发方面的工作。
“科学研究的过程,挫折会一直存在。因为这是一个探索的过程,做错的时候要比做对的时候多得多。”陈列平感慨道,“遇到挫折你会很难过,平时我的学生们有挫折都会来找我,于是这些挫折也会变成我的挫折。我的作用是帮助他们解决问题以及想办法让他们从挫折中走出来"。
对于一个科学家来说,要有恒定的信念。“你要想在一个领域里特立独行,就不要过于考虑别人对你的评价。作为一名研究人员,不要老想进入主流科学,因为一旦成为‘主流科学家’,那说明你的创新能力可有问题了。反过来,如果你不是主流科学家,你可能不被认可、获得支持甚至是被人信任,这时候你需要一个好的心态:我是在探索一个全新的科学发现”。
古今中外,大多数科学家都愿意待在一个主流的学术圈里面,这会给他们带来安全感,也因为这个缘故,绝大多数的重大科学发现只会光顾那些孜孜不倦、孤独地上下求索的先行者们。所谓的主流科学,只不过是主流科学家在先人已开辟出来的领域里,走完他们未尽的道路。
当谈及获奖时的感受时,陈列平表示“当时没有什么特别的感受,因为抗 PD-1/PD-L1 药物在肿瘤治疗中已表现得非常出色,获奖并没让我感到惊讶。不过有一点感触是,在获奖之前,没有多少人关注你,虽然那时候我们已经发表了上百篇相关的文章。 直到临床结果出来以及获奖之后,很多人的态度才有所转变,这些文章才被关注和大量引用”。
科研如何与产业有机结合
“如果我只专注基础研究,那么我可能会发表比现在多一倍的文章,因为我有50%的精力花费在转化医学上。做研究、做临床、做企业,需要了解三种不同的‘语言’,做到这一点并不容易。”
最近几年,转化医学在国内特别火热。但是实际上,很多科学家可能并不擅长这方面的工作。一个科研项目的成功转化,其实是需要在一开始的时候就要设计好。
“我是一个比较另类的科学家,做过医生,还在药厂经过一番历练,对药物的研发流程比较清楚。我的实验室也比较另类,与其说是一个实验室,还不如说是两个实验室:一组做非常基础的研究,如免疫逃逸、分子机制等;另一组则属于应用型,这里有医生,也有药物研发的研究人员。”陈列平表示,“不仅是学术界,我与医院、产业界一直保持密切的联系。当不同学术背景和兴趣的人,从各种角度讨论一个科学发现,这是一个很有意思的过程。”
基础研究与应用研究相互结合是陈列平理想的实验室模型, 但真正做起来其实并不容易,“因为基础和应用研究需要从不同渠道申请经费,我们既要在基础领域,同最好的实验室比较,也要在应用领域,与这个领域最好的实验室竞争,只有两方面做得最好,才可能申请到经费。”
“对我来说,只要有机会转化基础发现成为药物,我就不会放过转化的机会,“陈列平表示,”如果让其他公司或研究人员来转化,因为研究的深度和角度不同,他们有时在转化过程中出现错误,这样一个好药也会被他们弄坏。
转化医学说起来容易,做起来并不容易,十分费时、费力。“你必须要花费很多时间,甚至是牺牲个人的研究兴趣,把精力集中在转化医学上,在这个过程中, 80% 的工作是非科学部分,例如商业模式、经费管理、和临床医生交流、说服投资者等。如果我只专注基础研究,那么我可能会发表比现在多一倍的文章,因为我有50%的精力花费在转化医学上。做研究、做临床、做企业,需要了解三种不同的‘语言’,做到这一点并不容易”。目前,基于陈列平实验室的发现,除了 PD-1/PD-L1 抗体外, 还有至少有 6 个蛋白药物已进入临床I期或是临床II期实验,用于治疗晚期肿瘤和自身免疫疾病。
国内科研缺乏原创环境
“很多中国科研人员都是在追踪热点研究,中国相关政策亦在鼓励跟进,这可能是方向性错误。此外相关制度缺乏耐心,也是对原创研究极为不利的。“
陈列平坦言,中国在肿瘤免疫治疗领域落后国外很多年。“我走访了国内一些高校和企业,目前他们也在密切关注这一领域,但做得比较深入的研究几乎没有。很多中国科研人员都是在追踪热点研究。中国相关政策亦在鼓励跟进,这可能是方向性错误。”
“事实上,一开始我想把早期的一些基础肿瘤免疫研究拿回国内来做,然后再很快地转化到应用上来,但中国的科研环境以及相关政策似乎并不鼓励这样做。”陈列平无奈地表示,“我会很有耐心做这件事情,但是其他人可能没有耐心等待,也许是制度没有耐心,这对原创研究是极为不利的。”
“在耶鲁大学,我可以建自己心中理想的实验室,做想要做的研究,没有很多行政干预。这一点在国内却有些不同,如果国内科学家这样做,需要面临更大的压力,因为中国科研政策的导向性很强,今年做什么,明年做什么,都已经设计好,否则很难拿到经费。在你被孤立的时候,是否仍能做出新的东西,这需要经受极大的考验。纵然科研的行政导向也有必要,但是如果给研究者更高的自由度,这会极大地调动他们的积极性。”
陈列平说,“美国还有一个很有意思的现象,不同的大学科研环境不尽相同,但你总是可以找到一个适合你的地方。我是一个很‘孤独’的科学家,在耶鲁大学,像我这样的人还有很多,正所谓物以类聚。平时我们会各做各的研究, 但会相互欣赏,如有可能也会互相帮助”。如何创造环境鼓励科学家做原创研究,这样的曙光似乎已在国内渐次浮现,不过仍然很遥远。
作者: 夺标 时间: 2016-5-1 13:20
Nature Review:肿瘤免疫治疗新靶点——NK细胞
日期: 2016年01月05日
[url=]一键分享[/url]

20世纪70年代开始,自然杀伤(Natural Killer,NK)细胞既开始进入人们的视线,然而,近40年来,利用NK细胞进行抗肿瘤的治疗的研究却一直没有亮点突破,疗效亦无定论。随着免疫卡控点抑制剂和CAR-T技术等问世,NK细胞能否寻找到新的契机呢?近日Nature Reviews的文章介绍了NK细胞抗肿瘤治疗的新希望。
NK细胞简介
NK细胞是一群不同于T、B淋巴细胞的大颗粒淋巴细胞。其主要来源于骨髓CD34+的淋巴细胞,具有1.识别与溶解肿瘤细胞和病毒感染细胞;2.产生免疫调节性细胞因子两大主要功能,是人体抗感染和防止细胞恶性转化的重要免疫调节细胞。一般将人体内CD3-CD56+淋巴细胞认定为NK细胞,根据细胞上CD56分子表达密度的差异,将NK细胞分为CD56dim和CD56bright两个亚群。CD56dim占NK细胞90%以上,主要为细胞毒作用,表达中度亲和力的IL-2受体(IL-2R),具有更强的杀伤活性;CD56bright可产生大量细胞因子,主要起免疫调节作用,高表达IL-2R。
NK细胞的活化机制
NK细胞的 “动态平衡”状态受细胞表面多种受体蛋白的调控,简言之,分为2类:杀伤细胞活化受体(KAR)和杀伤细胞抑制受体(KIR)。正常情况下,KAR与自身细胞上多糖类抗原结合产生活化信号,同时KIR与MHCI类分子结合,产生抑制信号且占主导地位,以保证自身组织细胞不被破坏(图1a);当细胞表面MHC I类分子发生改变或减少缺失,影响与KIR结合,不能产生抑制性信号,NK则活化,产生杀伤效应(图1b);肿瘤细胞亦可通过过表达表面抗原与KAR结合,此时活化信号超过抑制信号,继而激活NK细胞(图1c);此外,NK细胞还表达IgG1和IgG3的低亲和力受体FcγRIII(CD16),可与肿瘤抗原特异性抗体Fc段结合,介导NK细胞识别并杀伤被抗体包被的肿瘤细胞,亦称为抗体依赖性细胞介导的细胞毒作用(antibody dependentcell-mediated cytotoxicity, ADCC)(图1d)。

图1. NK细胞功能示意图
NK细胞表面受体
NK细胞识别自我与非我并不需要体细胞基因重排产生识别不同抗原的克隆,而是表达多种受体执行功能。NK细胞受体主要包括免疫球蛋白超家族(如KIR),C型凝集素家族如NKG2受体,天然细胞毒性受体(NCR):NKp46、NKp44和NKp30,下表例举主要的受体及其调节功能:

NK细胞作用机制
目前认为NK细胞主要通过以下途径发挥杀伤作用:1.NK细胞直接通过胞吐作用释放穿孔素和颗粒酶等细胞毒性颗粒,活化caspase途径诱导靶细胞凋亡;2.活化NK细胞表达Fas(CD95)配体和TRAIL(TNF related apoptosisinducing ligand)分子,诱导CD95+靶细胞和TRAIL受体阳性的靶细胞通过内源酶的级联反应发生凋亡;3.细胞因子介导的杀伤作用,NK细胞能合成和分泌多种细胞因子,如IFNγ、TNFα、IL1、IL5、IL8、IL10和GCSF;4. ADCC作用。
肿瘤细胞如何逃逸NK细胞攻击

图2. 肿瘤细胞逃逸NK细胞机制
如图2所示,肿瘤细胞主要通过一下途径逃逸NK细胞攻击:a.血小板包被肿瘤细胞,并释放TGF-β等免疫抑制因子,表达GITR配体与KIR结合或下调KAR,抑制NK细胞激活;b.肿瘤细胞分泌免疫调节分子,如PGE2、IDO、TGF-β和IL-10等;c. 肿瘤细胞分泌可溶性NKG2DL,中和NK细胞表面受体;d.肿瘤微环境中基质细胞等分泌免疫抑制因子,表达NKG2DL,下调NK细胞表面受体。
NK细胞与免疫检验点抑制剂
某些激活的NK细胞表达PD1和CTLA4。研究者在多发性骨髓瘤患者体内检测到其NK细胞表达PD1,应用PD1单抗(CT-011)后能修复NK细胞介导的抗肿瘤效应;此外,应用PDL1的IgG1单抗还可能激发NK细胞的ADCC。NK细胞表面KIR类的抑制性受体(KIR2DL1, KIR2DL2 和KIR2DL3)可与MHC I类分子结合,抑制NK细胞活化,体外实验表明,应用IPH2102单抗阻断KIR2DL1-3,可以增加NK细胞的抗肿瘤活性(作用机制图3所示)。在AML和MM的临床I-II期研究已证实anti-KIR的安全性,虽然目前anti-KIR单独应用没有展示出显著的抗肿瘤效应,然而其与CTLA4或PD1抑制剂联用值得期待。

图3. 抗体封闭NK细胞抑制性受体,激活NK细胞
嵌合抗原受体(CAR)技术与NK细胞结合
CRA-T大家都耳熟能详,模仿CAR-T的CAR技术,已研发出CAR-engineeredNK cell(如图4所示),其原理亦是通过在NK细胞表面嵌合肿瘤特异性抗原受体,靶向识别并摧毁肿瘤细胞。体外实验提示,其CAR-engineered NK cell展示出较ADCC更强的细胞毒作用,可能与CAR与肿瘤表面抗原结合较IgG-CD16展示出更强的亲和力,目前CAR-engineered NK cell还处于研发阶段,期待其在体内试验中的疗效。

图4. CAR-engineeredNK cell
双特异性分子联结NK细胞活化受体和肿瘤细胞
如图5所示,以NK细胞表面活化受体CD16和NKG2D为靶点的双特异性分子,可以靶向NK细胞识别并杀伤肿瘤细胞。

图5. 双特异分子联结NK活化受体和肿瘤细胞
以NK细胞为基础的肿瘤免疫治疗
NK细胞在免疫监视中扮演着非常重要的角色,随着对NK细胞的分子特征和功能的进一步探索,开发以NK细胞为基础的靶向免疫治疗可能引发肿瘤免疫治疗的新突破,图6展示了以NK为基础的潜在免疫治疗靶点。

图6. 以NK细胞为基础的肿瘤免疫治疗
结语
在多家巨头纷纷投入CAR-T免疫疗法的同时,以NK细胞为核心的细胞治疗技术公司亦已上市,在概念上,因CAR-engineeredNK cell能敲除NK细胞内抑制性信号通路,似乎更优于CAR-T,是否真如理论所示,我们拭目以待。
参考文献:
NK cells and cancer: you can teach innate cells new tricks
作者: 夺标 时间: 2016-5-1 13:21
从专业医疗技术角度解读百度与年轻人魏则西之死2016-5-1 作者:MedSci 来源:MedSci 我要评论1
 Tags: 百度 魏则西
Tags: 百度 魏则西
分享到:[url=]0[/url]
故事过程——
一名罹患滑膜肉瘤这种罕见的癌症的患者魏则西,因为轻信百度搜索的结果,选择了北京一家部队医院的“号称与美国斯坦福大学合作的肿瘤生物免疫疗法”,最终去世。他在知乎上一段留言引发深思与公众讨论。他回答的这个问题是“你认为人性最大的‘恶’是什么?详细也可以看这里:
魏则西事件始末!百度 莆田系被严重质疑!网友有槽(Dr-Venting)深度揭示百度竞价与部队医院的DC-CIK细胞治疗的黑幕,具体细节,大家可以从网络上搜索得到。
有槽(Dr-Venting)最终结论:
(1)魏则西去的这家医院,是北京武警二院肿瘤生物中心,所接受的是DC-CIK细胞免疫治疗,这是种已经被国外淘汰、但在中国非常红火的肿瘤免疫治疗
(2)首先要确认的是,生物免疫、免疫细胞疗法并不是“假”疗法,在世界多家医院和科研机构都有相关临床研究。治疗过程中,医生通过抽取患者的免疫细胞,在体外扩增和加工,并重新输回患者体内,从而达到提高患者免疫能力,抑制或预防肿瘤生长的目的。
(3)北京这家号称与斯坦福医学院合作,实际上子虚乌有!
(4)百度是重要的罪魁!
(5)这家部队医院的细胞治疗科室背后实际上是莆田人在控制,还可能控制了很多相关的医院科室。
怎样远离问题医院?
首先,凡事不要问百度,凡事不要问百度,凡事不要问百度。原因不再解释。
第二,谨慎对待部队医院。部队医院大量赢利科室被莆田系承包的问题已经说了无数次,男科、妇科、不孕不育、皮肤性病、中医这些科室是重灾区,但我也没想到,连肿瘤病人的钱他们也要赚,肿瘤病人的命他们也要榨。
关于免疫细胞治疗和肿瘤免疫治疗的真实状况
肿瘤是十分难以治疗的疾病,尤其是罕见的恶性肿瘤,更是缺乏有效治疗方案。实际上,肿瘤免疫治疗,经历了近一个世纪的波折。从最早上世纪50年代以前,大家寄予厚望,希望通过激发自身免疫细胞的能力,达到消灭肿瘤的目的(包括通过细菌感染,或注射某些药物激发机体免疫功能等)。最终各方面努力,都是无疾而终(仅在极少数肿瘤中获得小的进展)(
250年来人类抗击癌症的里程碑式进展(1775-2015))。
在上世纪80-90年代,基于免疫细胞的过继免疫策略成为新的思路,通过体外将免疫细胞进行处理,以诱导出可能具有杀伤肿瘤能力的细胞,进而进行治疗。欧美率先进行了相关探索,最终依然令人失望(
癌症小百科:历史,现状和未来点点滴滴)。
但这一波浪潮中,在中国是2005年以后兴起的,在传统CIK基础上进行一定的优化与改进,以及希望通过肿瘤细胞免疫形成具有“疫苗”能力的DC疫苗等角度,希望提高对肿瘤的杀伤作用。在中国以CIK和DC研究为主,在日本以NK细胞研究为主,而在欧美基本已放弃类似的研究。确实在这里查询:
https://clinicaltrials.gov/ct2/results?term=DC-CIK,几乎所有的DC-CIK临床试验都来自中国学者,暂时在临床上看不到确切疗效的技术,直接上临床还是值得商榷的,还应该在基础科研方面多下工夫,有重大突破后再上临床更为合适。
这也让免疫治疗肿瘤看到新的可能。在CIK和DC治疗肿瘤陷入困境后,又一种新的基于细胞的免疫治疗横空出世---
CAR-T治疗方法。在短短几年便经历数代,不断改进,目前在黑色素瘤,血液肿瘤中都取得令人吃惊的疗效!虽然,目前中国在CAR-T方面研发稍微落后于美国一些,但是,国内有不少学者快速从传统的CIK和DC中转身进行CAR-T研究,也取得不俗的成绩!在CAR-T在血液肿瘤取得巨大成功后,促使人们思考,能否用于其它实体瘤?这是最近研究的焦点。
当然,除了CAR-T外,TCR-T细胞治疗也可能具有潜力。美国癌症研究所的Steven Rosenberg教授就启动了一项针对晚期滑膜肉瘤和恶性黑色素瘤的新技术临床研究(TCR-T技术),在公开发表的结果中,招募了18例NY-ESO-1(+)滑膜肉瘤患者,11例对TCRT治疗有反应(Clin Cancer Res. 2015 Mar 1;21(5):1019-27. )。(
https://clinicaltrials.gov/ct2/show/NCT01967823)
然而,一系列令人失望后的兴奋和成绩,只能说,肿瘤免疫治疗仍然在路上,还没有普及推广到各种肿瘤!目前只在部分肿瘤中取得不俗的战果,但是能否普遍应用于各种肿瘤中,还有待进一步的证据支持。
对于魏则西,一位专家阐述这样的观点,供大家参考:这是一个不好的例子,表面上是谴责百度、武警二院和莆田系(当然需要谴责),实际上又要引起医患矛盾及对免疫治疗的误解!肿瘤目前为止仍是不治之症,不管是免疫疗法还是其它疗法。固然花了这么多钱没有治好让人感到惋惜,但换了别的治疗,也同样挽救不了生命。免疫疗法从来就不是治疗癌症的一线疗法,但对缓解病情,减轻其它治疗带来的副作用,改善病人生存质量还是有明显作用的(切不说目前开展的一些新技术)。就文中提到的DC-CIK本身,关键问题还在于免疫细胞的质量与数量,适应症的选择。就这个病例而言,也许免疫治疗不是最好的选择,或者我更怀疑是免疫细胞的质量问题。但任何治疗,尤其是癌症的治疗都不是百分之百有效,不能等治疗失败后反过来抱怨或指责!百度的竞价排名是个恶瘤,利益驱动结果。但纵观目前各行各业哪个不是利益驱动?一味谴责百度,不如自己自律!那个公司是否真正采用美国技术文章中很明确,其实是照抄美国技术,但抄的怎样就不知了。美国也不是不用DC-CIK,而是有了更好的代替,如CAR-T,NK等。但并不是DC-CIK不好,如果有“好”抗原负载,也应该不错。将来也许会有更好的进展。媒体上所谓”谋财不害命”或“谋财害命”都是哗众取宠,不是认真的态度。这件事百度要改,医院要吸取教训,但不能由此而阻碍免疫治疗技术的发展。另外,由此引申的思考,多少肿瘤患者由各种治疗而死亡?多少患者由不正规的私人医生治疗或验方、秘方治疗而死亡?我就不赞成目前流行的广告,没有买卖就没有伤害,不从源头上制止犯罪,而怪罪于交易的人们,于这个事件又何其相似也?"
当然,上述观点也只是一家之言,至少目前DC-CIK还没有令人信服的技术突破,在当前CAR-T技术有明显突破时,确实需要更换和升级新的技术。当然,如果作为基础研究实验,仍然可以探索DC-CIK技术,也许在将来技术革新后,才能真正发挥作用。
但是,作为专业医疗技术,如何正确看待这些医疗新技术呢?是一棍子打死,还是任凭混乱下去?对于已淘汰的技术,以及极富有潜力的新技术,应该用不同的眼光对待。如果任凭媒体全面批驳细胞免疫治疗,这样相当于泼脏水连孩子一起扔掉。
梅斯医学认为,我们应该呼吁:
(1)在DC-CIK技术没有明确突破之前,不应该直接、过快用于临床
(2)已被验证的新的细胞治疗技术,如CAR-T要大力发展,对于有潜力的TCR-T,CAR-NK,taNK要加大研发力度
(3)不管什么新技术应用于临床,患者应该有充分地知情同意,应该明确用科学证据告诉患者,而不能夸大效果!哪怕是当下最牛的PD-1/PD-L1和CAR-T治疗,即使在血液肿瘤,黑色素瘤中,仍然有相当多的患者疗效不佳。医学技术没有终点,只有不断改进,这就是科学!
(4)应该规范免疫细胞治疗市场,让骗子退出,让优秀的技术应用于患者,改善患者生存质量!
小结:
肿瘤免疫治疗,包括小分子免疫药物,大分子单抗,以及肿瘤细胞治疗(以CAR-T和CAR-NK为代表),都是未来肿瘤免疫治疗的希望,需要大力研究与发展。对于DC-CIK这些被临床上暂时证明并没有确切疗效的技术,应该只进行科学研究(动物实验层面),而不应该直接上临床。
当然,千言万语一句话:科学就是科学,骗子太多的时代,各位在睁大眼睛!
附1:免疫治疗大事记(当然,这些大事中,与CIK无关,内容来自网友的整理)
免疫疗法大事纪:1992年,美国
FDA正式通过将生物免疫疗法视为癌症基本疗法之一的议题,该疗法在美国临床得到广泛应用。
2000年,美国Yamazaki 博士等人在《
柳叶刀》杂志报道了生物免疫疗法治疗肝癌的临床试验结果,结果显示该技术能够有效预防肿瘤的转移和复发。
2008年第358期《新英格兰医学杂志》,刊登美国MD安德森癌症中心对一名52岁男性恶性黑色素瘤患者在进行免疫治疗的报道。免疫治疗前,其肿瘤复发并伴随转移,并对高剂量α-干扰素、4周期的高剂量白介素-2及局部切除的治疗方式无效。后给予患者体外扩增并回输特异性CD4+ T细胞,两个月后患者所有的病灶消失,两年内没有肿瘤的复发。这是医学界首例利用复制免疫细胞的方法成功治愈癌症的个案。不过,后来在各种肿瘤上没有得到很好的再现。
2011年10月,Ralph M. Steinman“发现树突状细胞和其在后天免疫中的作用”获得诺贝尔医学奖,标志着生物免疫治疗成为癌症治疗的新型疗法(
2011年诺贝尔生理学或医学奖新鲜出炉)。
附2:中国有关细胞治疗和肿瘤免疫治疗大事记,(内容来自网友的整理)
2009年3月,中国卫生部颁布的《医疗技术临床应用管理办法》中,将“自体免疫细胞治疗技术”纳入第三类技术进行管理,同时通过审批的医疗机构可开展临床应用。
2011年4月,CCTV《新闻联播》对生物免疫治疗技术进行了报道,指出生物免疫疗法治疗肿瘤取得重点突破,早期癌症三分之一可治愈。
MedSci注:这有明显的夸张!例如2008中国十大科技骗局:
体细胞治疗乙肝,当年也是上了CCTV的哦。
2012年3月6日,中国卫生部正式将生物免疫治疗癌症纳入技术管理办法中。
2012年4月15日,中国政府正式将治疗技术生物细胞免疫入医保,标志着生物免疫疗法正式进入国内医疗保障体系。
第7届中国抗癌协会临床肿瘤学协作专业委员会(CSCO)上,专家指出“肿瘤生物免疫疗法成为最令人瞩目、最鼓舞人心的焦点,将成为21世纪人类攻克癌症具有战略意义的一个重要方面。”我国知名医学专家郝希山院士在业内
会议上也特别指出:生物治疗通过调动人类自身机体的防御机制,可抑制肿瘤生长,实现患者自身机体的“自主抗癌”,有望达到完全消灭癌细胞并根治癌症的目的,将成为未来癌症治疗的一个主要方向!
截至2016年5月1日,在全球公布的74个有关CAR-T的临床试验中(Clinicaltrials数据),中国大陆占34个,接近美国(35个)!在CAR-T的研究中,中国人这次没有落伍(数据见:
https://clinicaltrials.gov/ct2/results/map?term=CAR-T)。不过,在PD-1的临床试验中,全球共有243项临床试验,但大中华区(不含日本)为32项,但是中国大陆仅5项,与美国的166项相比,落后太多,也比不上韩国(14项)以及中国台湾省(11项),这也与这些划时代药物都是欧美大药厂研发的结果
作者: 夺标 时间: 2016-5-1 13:25
FDA受理PD-1免疫疗法Keytruda治疗晚期非小细胞肺癌的申请2016-3-8 作者:佚名 来源:不详 我要评论1
 Tags: 默沙东 Keytruda 非小细胞肺癌
Tags: 默沙东 Keytruda 非小细胞肺癌
分享到:[url=]0[/url]
美国制药巨头默沙东(Merck & Co)在研PD-1免疫疗法Keytruda(pembrolizumab)近日在美国监管方面传来喜讯,
FDA已受理Keytruda治疗晚期非小细胞肺癌(
NSCLC)的补充生物制品许可(sBLA)。此次sBLA的提交,是基于一项关键性II/III期临床研究KEYNOTE-010的数据,该研究在晚期非小细胞肺癌(NSCLC)患者中开展,首次采用基于PD-L1表达状态的前瞻性测定方法,评估了Keytruda相对化疗的潜力。研究结果显示,在任意PD-L1表达水平(≥1%)的NSCLC患者中,与化疗相比,Keytruda显著延长了总生存期(OS)。该研究的数据已发表于2015年12月的《
柳叶刀》(Lancet)(
Lancet:Pembrolizumab能够显著延长PD-L1阳性晚期非小细胞肺癌患者的生存期)。
肺癌方面,此前Keytruda已于2015年10月获FDA加速批准,用于经FDA批准的一款伴随诊断试剂盒证实为PD-L1表达阳性且接受含铂化疗治疗期间或治疗后病情进展的转移性非小细胞肺癌(NSCLC)的治疗,该批准是基于肿瘤缓解率和缓解持续时间。关键性II/III期临床研究KEYNOTE-010的数据,将支持Keytruda的完全批准。
当前,PD-1/PD-L1免疫竞赛异常激烈,市场峰值高达350亿美元,该领域的佼佼者包括默沙东、百时美施贵宝、罗氏、阿斯利康。此次竞赛中,百时美PD-1免疫疗法Opdivo遥遥领先,默沙东PD-1免疫疗法Keytruda则紧跟其后,而罗氏的PD-L1免疫疗法atezolizumab和阿斯利康的PD-L1免疫疗法durvalumab(MEDI4736)尚未收获任何适应症。据医药市场调研机构EvaluatePharma预测,Opdivo将成为PD-1/PD-L1领域最成功的免疫疗法,2020年销售额将达到88亿美元,而Keytruda也将达到55亿美元,罗氏atezolizumab峰值仅为20亿美元。
PD-1/PD-L1免疫疗法是当前备受瞩目的新一类抗癌免疫疗法,旨在利用人体自身的免疫系统抵御癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力。目前,各大巨头正在火速推进各自的临床项目,调查单药疗法和组合疗法用于多种癌症的治疗,以彻底发掘该类药物的最大临床潜力。
KEYNOTE-010研究:
KEYNOTE-010研究涉及1034例表达PD-L1(肿瘤比例评分TPS≥1%)的晚期非小细胞肺癌(NSCLC)患者。研究中,与多西他赛化疗组(n=343)相比,FDA批准的Keytruda剂量组(2mg/kg,每三周一次,n=345)和一种实验性剂量组(10mg/kg,每三周一次,n=346)具有相似的结果。PD-L1表达状态采用安捷伦旗下Dako北美公司开发的免疫组织化学伴随诊断试剂盒PD-L1 IHC 22C3 PharmDX进行评估。来自KEYNOTE-010研究的发现,是基于最终研究分析。中位随访时间为13.1个月(IQR,8.6个月-17.7个月)。
总生存(OS)数据:
在整个研究人群(所有PD-L1表达水平)中,与多西他赛化疗组相比,Keytruda 2种剂量治疗组总生存期(OS)均显著延长。具体为,Keytruda 2mg/kg每三周一次剂量组OS提高29%(HR 0.71, P=0.0008; 95% CI, 0.58-0.88),预计的一年总存活率为43.2%,中位OS为10.4个月(95% CI, 9.4-11.9);10mg/ke每三周一次剂量组OS提高39%(HR 0.61, P<0.0001; 95% CI, 0.49-0.75),预计的一年总存活率为52.3%,中位OS为12.7个月(95% CI, 10.0-17.3);多西他赛治疗组预计的一年总存活率为34.6%,中位OS为8.5个月(95% CI, 7.5-9.8)。
在PD-L1表达水平较高(TPS≥50%)的患者中,Keytruda 2个剂量组均优越于多西他赛化疗组。具体为,与多西他赛治疗组相比,Keytruda 2mg/kg每三周一次剂量组OS提高46%(HR 0.54, P=0.0002; 95% CI, 0.38-0.77),中位OS为14.9个月(95% CI, 10.4-未达到);10mg/ke每三周一次剂量组OS提高50%(HR 0.50, P<0.0001; 95% CI, 0.36-0.70),中位OS为17.3个月(95% CI, 11.8-未达到);多西他赛治疗组中位OS为8.2个月(95% CI, 6.4-10.7)。
无进展生存(PFS)数据:
在整个研究人群(所有PD-L1表达水平)中,与多西他赛化疗组相比,Keytruda 2种剂量治疗组无进展生存(PFS)均得到延长,但数据无统计学显著差异(2mg/kg:HR 0.88 [95% CI, 0.74-1.05,P=0.07];10 mg/kg:HR 0.79 [95% CI, 0.66-0.94,P=0.004])。具体为,Keytruda 2mg/kg每三周一次剂量组中位PFS为3.9个月(95% CI, 3.1-4.1);10mg/ke每三周一次剂量组中位PFS为4.0个月(95% CI, 2.7-4.3);多西他赛治疗组中位PFS为4.0个月(95% CI, 3.1-4.2)。
在PD-L1表达水平较高(TPS≥50%)的患者中,与多西他赛化疗组相比,Keytruda 2种剂量治疗组无进展生存期(PFS)均得到统计学意义的显著延长(2mg/kg:HR 0.59 [95% CI, 0.44-0.78, P=0.0001];10 mg/kg:HR 0.59 [95% CI, 0.45-0.78, P<0.0001])。具体为,Keytruda 2mg/kg每三周一次剂量组中位PFS为5.0个月(95% CI, 4.0-6.5);10mg/ke每三周一次剂量组中位PFS为5.2个月(95% CI, 4.1-8.1);多西他赛治疗组中位PFS为4.1个月(95% CI, 3.6-4.3)。
研究中,Keytruda的安全性与以往在晚期肺癌群体中开展的Keytruda临床研究的安全性一致。关于该项研究,之前美国耶鲁大学癌症中心医学肿瘤学首席Roy Herbst医师评论道,这是一个激动人心的时刻,与Keytruda相关的诸如KEYNOTE-010的研究为更好地了解如何给每个病人对症下药铺平了道路。这些研究结果表明,Keytruda为PD-L1表达阳性的晚期肺癌群体提供了优越的总生存利益,并支持了Keytruda在肺癌临床治疗中的潜力。
作者: 夺标 时间: 2016-5-1 13:25
本帖最后由 夺标 于 2016-5-1 14:27 编辑
PD-1 抗体临床研究结果汇总2015-5-7 作者:佚名 来源:生物探索 我要评论4
 Tags: PD-1 临床研究 抗体
Tags: PD-1 临床研究 抗体
分享到:[url=]1[/url]
PD-1程序性死亡受体是一种重要的免疫抑制分子,为CD28超家族成员。PD-1主要在激活的T细胞和B细胞中表达,功能是抑制细胞的激活,这是免疫系统的一种正常的自稳机制,因为过度的T/B细胞激活会引起自身免疫病,所以PD-1是我们人体的一道护身符。
肿瘤细胞所具有的逃避免疫系统的能力,是通过在其表面产生的程序性死亡配体(PD-L1)结合到T细胞的PD-1蛋白上实现的。机体内的肿瘤微环境会诱导浸润的T细胞高表达PD-1分子,肿瘤细胞会高表达PD-1的配体PD-L1和PD-L2,导致肿瘤微环境中PD-1通路持续激活,T细胞功能被抑制而不能发现肿瘤以至于不能向免疫系统发出需要攻击肿瘤和杀伤肿瘤细胞的治疗。PD-1抗体是针对PD-1或者PD-L1的一种抗体蛋白,使得前两种蛋白不能发生结合,阻断这一通路,部分恢复T细胞的功能,使这些细胞能够继续杀伤肿瘤细胞。
关于PD-1抗体的临床疗效,目前已有的结果包括:PD-1抗体能控制 50%皮肤癌的癌症进展,治愈10%左右的皮肤癌病人;也能控制24%具有顽固非小细胞肺癌的病人。百时美施贵宝最新的临床试验显示他们的PD-1单抗nivolumab [Opdivo] 能使41%的患者存活超过一年。
最新的研究结果包括:
1. MPDL3280A可使转移性三阴乳腺癌长期缓解
在2015AACR年会上,约翰霍普金斯基梅尔癌症中心(Kimmel Cancer Center)的肿瘤内科学副教授 Leisha A. Emens, MD, PhD做出的报道指出,MPDL3280A这一具有抗PD-L1作用的单克隆抗体,在晚期三阴性乳腺癌中表现出了持久的疗效。乳腺癌是威胁我国女性健康的头号恶性肿瘤,其中转移性三阴乳腺癌是出了名的难治,而且在接受化疗的患者中,长期缓解是很难获得的。MPDL3280A的疗效无疑为肿瘤患者带来了新的希望。这项研究共纳入54名转移性三阴性乳腺癌受试者,每三周接受一次MPDL3280A注射。在所有21个可评估疗效的受试者中,免疫细胞的PD-L1水平达到或超过5%。总体有效率为19%(95%CI:5%-42%),24周无进展生存为27%(95%CI:7%-47%)。其中,完全缓解两例,部分缓解两例。更让人惊喜的是,这里面有3个患者在停药之后仍然维持了缓解。受试者的目标病灶缩小,但其他地方出现了新的病灶。然而这些新病灶最终还是对治疗表现了应答。在54个可评估安全性的受试者中,MPDL3280A耐受良好。乏力、恶心、发热、食欲下降、虚弱是最常见的治疗相关不良事件。11%的受试者出现了3级治疗相关不良事件,仅有1例出现4级肺炎。2例死亡原因正在调查当中。
2.Keytruda治疗恶性胸膜间皮瘤疾病控制率高达76%
根据默沙东公布的Keytruda(pembrolizumab)治疗实体瘤的一项Ib期KEYNOTE-028研究数据,Keytruda治疗在25例胸膜间皮瘤(pleuralmesothelioma,PM)患者中取得了28%的总缓解率(ORR),并有48%的患者病情稳定,疾病控制率达到了76%。在分析数据时,有40%(n=10/25)的患者仍然在接受治疗。该研究中,不良事件与以往报道的Keytruda安全性数据一致。治疗相关的最常见不良事件(发生于≥20%患者)包括疲劳(24%)、恶心(24%)。研究中未发生治疗相关不良事件的停药,也没有发生治疗相关的死亡事件。胸膜间皮瘤(PM)是一种原发于胸膜间皮的罕见、侵袭性、恶性肿瘤,治疗选择极其有限。外科手术是该病的主要治疗方法,术后辅助放疗能控制肿瘤的局部复发,并延长生存期。
3. Keytruda和Opdvio治疗血癌的潜力
对当前任何已获批药物均无治疗反应的晚期霍奇金淋巴瘤(HL)患者,接受默沙东Keytruda和百时美Opdvio治疗后,能够达到完全缓解。该研究发现表明PD-1/PD-L1检查点抑制剂可以调动患者自身的免疫系统来识别并杀死某些类型的血癌细胞。Adcetris是目前唯一批准用于晚期霍奇金淋巴瘤治疗药物,但默沙东的Ib期临床研究纳入的29例难治霍奇金淋巴瘤(HL)患者在治疗后出现了病情复发。同时,这些患者中有20例患者此前经干细胞移植治疗失败,其余9例患者无资格或拒绝干细胞移植。数据显示,经Keytruda治疗24周后,总缓解率为66%(n=19/29),6例实现完全缓解(n=6/29,21%),其余13例实现部分缓解。在数据分析时,这19例患者中有17例仍然对Keytruda治疗有响应,平均缓解持续时间尚未获得。所有29例患者中,27例对Keytruda治疗表现出一定水平的响应或肿瘤缩小。而百时美的Ib期临床研究,则纳入了23例复发/难治霍奇金淋巴瘤(HL)患者(有87%的患者既往经超过3种疗法治疗失败,包括干细胞移植和Adcetris)。数据显示,经Opdivo治疗后平均随访40周,总缓解率为87%(n=20/23),完全缓解率为17%(n=4/23)。
4. 与Ipilimumab相比,Keytruda可以提高晚期黑色素瘤的整体生存率和无进展生存率
2015年4月19日发表在新英格兰医学杂志上的一项三期KEYNOTE-006临床试验,发现了Keytruda优于Ipilimumab的治疗效果。这项研究纳入了来自16个国家的834名患者,这些患者每两周(N=279)、每三周(N=277)进行接受一次Keytruda(N=279)或Ipilimumab(N=278)治疗。三组治疗患者之间年龄、性别、ECOG表现状态、升高的乳酸脱氢酶、转移情况、PD-L1阳性状态、BRAF V600E突变情况、脑转移、之前系统治疗情况之间都是匹配的。中位随访时间是7.9个月,平均暴露时间是164天(两周组)、151天(三周组)和50天(Ipilimumab组)。Keytruda治疗最常见的不良反应是:疲劳 (两周组,20.9%;三周组,19.1%), 腹泻 (16.9% vs. 14.4%), 脸红(14.7% vs. 13.4%), 和瘙痒 (14.4% vs. 14.1%). Ipilimumab治疗最常见的不良反应是瘙痒(25.4%), 腹泻(22.7%), 和疲劳 (15.2%)。
作者: 夺标 时间: 2016-5-1 13:26
免疫肿瘤药物概述与发展2015-6-6 作者:王守业 来源:科学网 我要评论2
 Tags: 免疫 肿瘤
Tags: 免疫 肿瘤
分享到:[url=]0[/url]

肿瘤免疫治疗是当今全球药物研发领域最大的热门,主要分为三大领域,其中之一就是免疫检查点抑制/封锁。免疫检验点抗体是通过抑制病人T细胞上的关键免疫检查点蛋白来激活自身免疫系统中的T细胞,从而消灭肿瘤细胞。所以,免疫检验点抗体就相当于将T细胞的“闸门”给打开了。免疫检验点抗体是当前国际单克隆抗体药物研发的大热门。靶向免疫检验点抗体的靶点目前已有报道的至少有7个,即:
CTLA4(cytotoxicT-lymphocyte-associated antigen 4,细胞毒T淋巴细胞相关抗原4)
PD-1(programmed cell death protein 1,程序性细胞死亡蛋白1)
PD-L1(PD-1 ligand, 程序性死亡配体-1)
LAG3(lymphocyte activation gene 3,淋巴细胞激活基因3)
B7-H3
B7-H4
TIM3,(T-cell membrane protein3,T细胞膜蛋白3)
一年一度的美国临床肿瘤学会
会议 (
ASCO)本周二刚在芝加哥落幕。据统计,PD-1/PD-L1是本次
会议数千篇
会议摘要中最火的关键词,风头已然盖过了此前最火的HER2。另外,此前也有CTLA4靶点药物Ipilimumab上市,未来其它靶点药物上市,也将成为亮点。
在上述提及的7个靶向免疫检验点的抗体靶点中,靶向CTLA4的单克隆抗体已由百时美施贵宝(下称施贵宝)公司开发成功(即Ipilimumab,商品名为 Yervoy),2011年被
FDA批准上市用于治疗黑色素瘤。而靶向PD-1的单克隆抗体药由于和Yervoy相比,副作用更小、临床效果更优,近几年迅速成为全球新药研发热点。
肿瘤免疫治疗被认为是继手术、放疗、化疗和靶向治疗后又一革命性治疗方式。目前免疫治疗,尤其是靶向PD-1的单克隆抗体药的最新前沿有下述几大特点。
1)两家公司:目前,在免疫治疗领域最领先的两家公司是施贵宝和默沙东,位于第二梯队的也有两家公司,他们是罗氏和阿斯利康,都是国际上实力雄厚的大公司。如果论PD-1单抗药的研发进展,我国的百济可以算作第三梯队,而在此领域,百济无疑是国内公司的领先者;
3)两个国家:这两个药只在两个国家获批——日本和美国;
制药领域有一种所谓的“Pick the Winner”研发策略,这一策略在上述Opdivo和Keytruda两个药上表现得淋漓尽致:施贵宝的Opdivo目前有近90个临床试验正在进行,用于实验超过20种癌症,默沙东的Keytruda更是有上百个研究。显而易见,两家公司针对同一个靶点的抗体药都蛮“拼”的,相信这两种药会有更多的适应症获批。
另外,上述施贵宝和默沙东正在进行的近两百个临床试验中,有相当比例是组合疗法(即Yervoy/Opdivo/Keytruda联用,或与其它药物尤其是靶向化学药联用)。本周一从施贵宝传来好消息:Yervoy + Opdivo组合用于一线治疗晚期黑色素瘤的补充生物制剂许可申请(sBLA)已获FDA接受并开始审查。由于临床试验结果该组合疗法远优于Yervoy单用,该组合疗法还获得了FDA优先审查资格。这是免疫肿瘤领域首个组合疗法的sBLA申请,具有里程碑意义,预计在今年9月30日会获批上市(批准应该是没有悬念的)。
作者: 夺标 时间: 2016-5-1 13:28
2013年回顾:癌症免疫治疗药物加速崛起2014-1-6 作者:佚名 来源:生物探索 我要评论1
 Tags: 癌症免疫治疗
Tags: 癌症免疫治疗
分享到:[url=]0[/url]
2013年主要的药物研发事件毫无疑问是新一代癌症免疫治疗药物的崛起,这一话题主导了6月份的美国临床肿瘤学会(ASCO)年会。
百时美施贵宝旗下2011年获批的伊匹单抗在黑色素瘤方面已提供了大量的疗效证据,但令ASCO与会者惊呼并已快速进入3期临床研究的PD-1/PD-L1抗体似乎明显地更胜一筹。
百时美施贵宝伊匹单抗与Nivolumab的合并用药在早期黑色素瘤临床试验中显示有成功的希望,而默沙东旗下试验性抗PD-1抗体早期试验数据显示其能够将患者的黑色素瘤缩小。
PD-1/PD-L1抗体后期试验数据将会在2014年和2015年开始发布,因受到ASCO上发布的令人印象深刻的早期数据的影响,很多观点一致认为这些产品将成为新的癌症治疗模式的中坚。
百时美施贵宝2009年对Medarex的收购可能已成为癌症免疫治疗药物市场最重要的一次收购。相比之下,最近的试验数据暗示,默沙东或许会拥有最好的PD-1/PD-L1产品,但该公司在肿瘤药物市场的经验最少,并且最近几年其研发业绩也已被削弱。
Sanford C. Bernstein分析师Tim Anderson最近指出默沙东通过两项收购获得其PD-L1产品MK-3475,即2009年默沙东收购先灵葆雅,而先灵葆雅于2007年通过收购Organon而获得MK-3475,但在两次收购中MK-3475并未做为一个关键资产。
对阿斯利康来说,其癌症免疫治疗产品研发线虽处于早期,但在过去几年发展却非常迅速,
罗氏最近已宣布其PD-L1进入首批3期临床试验,其在癌症抗体及个体化药物方面的市场领先地位也明显使其实力得到增强,在免疫-肿瘤学竞赛中,抗体及个体化药物对罗氏塑造业绩可能会发挥不可或缺的作用。
随着更多预期数据的发布,2014年的ASCO上癌症免疫治疗药物仍将成为一个焦点。
作者: 夺标 时间: 2016-5-1 13:30
CSCO 2015:肿瘤免疫治疗:肿瘤治疗的未来趋势2015-10-15 作者:佚名 来源:生物谷 我要评论2
 Tags: 肿瘤免疫 治疗
Tags: 肿瘤免疫 治疗
分享到:[url=]0[/url]
恶性肿瘤是目前全世界的主要死亡原因之一,已经成为严重危害人类生命健康、制约社会经济发展的一大类疾病。《2014年全球癌症报告》称2012年全球癌症患者和死亡病例都在令人不安地增加,新增癌症病例有近一半出现在亚洲,其中大部分在中国,中国新增癌症病例高居第一位。在肝、食道、胃和肺等4种恶性肿瘤中,中国新增病例和死亡人数均居世界首位。
在日前召开的第十八届全国临床肿瘤学大会暨 2015 年 CSCO(中国临床肿瘤学会) 学术年会上,上海市胸科医院肿瘤科(上海市肺部肿瘤临床医学中心)主任陆舜教授就肺癌治疗新进展发表了专题讲话。10月13日下午,陆舜教授受邀参加了肿瘤免疫新进展媒体沟通会,与媒体共同分享和交流了肿瘤治疗的最新研究成果和未来趋势。
肿瘤治疗:存在众多未被满足的医疗需求
当前的肿瘤治疗水平,多数恶性肿瘤不能得到治愈。世界卫生组织提出,目前的肿瘤治疗目标是大幅度延长患者生命,并确保带瘤存活者的生活质量达到可能最佳程度。肿瘤目前的治疗方法很多,传统的肿瘤治疗方式包括外科手术治疗、放疗和化疗等。外科手术治疗虽然可以切除肿瘤,但是手术过程中可能无法完全切除或引起肿瘤转移,还可能造成器官损伤及身体免疫力降低;化疗是一种全身性的治疗,效果明显和迅速,但是在杀伤肿瘤细胞的同时也可能会把正常细胞一起杀灭,所以,化疗算得上是一种"玉石俱焚"的治疗方法;放疗在某些肿瘤方面可以达到手术切除的效果,但放疗成本高,周期长,并发症也较多。
传统的肿瘤治疗不能完全满足患者的治疗愿望,新兴的肿瘤治疗也随之而至,包括靶向治疗,激素治疗,特异性抑制剂,肿瘤免疫治疗等。
近年来,肿瘤免疫已成为肿瘤治疗研究领域的大热点。简单的说就是利用患者自身免疫系统杀伤或抑制肿瘤细胞。异物入侵机体时会形成抗原,激发机体的免疫系统,但肿瘤会产生一些信号分子来"刹住"机体免疫系统,使其不能正常发挥作用,而肿瘤免疫治疗就是对抗肿瘤这种"刹车"系统,从而让机体免疫系统重新正常工作,最终控制和杀伤肿瘤细胞。由于肿瘤免疫治疗作用的是免疫系统本身,所以理论上来说,它可作用于不同肿瘤治疗。
免疫检查点:特异性免疫治疗的基础
"打仗的时候,往往会在边界设置哨卡点,检查点。有敌人进入,他就能查到,把他们抓起来。一旦哨卡点产生问题,敌人进来我们不认识,哨卡点认为这是自己人,把他们放进来了,就导致癌症产生。"陆舜教授用了一个形象的比喻来解释免疫检查点的理论。这是国际上最新的肿瘤免疫治疗研究的理论基础。
理论上说,人生活在大自然的环境,不停地受到外界的刺激,物理的、化学的,很容易导致基因突变。为什么大多数人没有得癌症?因为人体本身就有免疫系统,我们有淋巴细胞,有免疫监视的机制。如果有什么变化,免疫系统自动发挥作用,把"外来的东西"干掉。而肿瘤病人这个机制产生了免疫耐受。
陆舜教授指出:"由于免疫应答出了问题,把敌人认为是我们自己的人,或者说我的部队产生问题了,我不能抗击敌人,这个时候免疫机制产生问题了。我们现在的科学研究发现免疫细胞有免疫检查点,现在已知的有20几个。我们已经在其中2个检查点找到了相应的药物,可以把产生耐受的机制打断,能够使它再恢复这个功能。把重新使我有战斗力去抗击。免疫细胞重新被激活,这就是我们现在特异性免疫治疗的基础。"这和有些医院打着所谓"免疫治疗"的招牌来"包治百病"不同,陆舜教授指出,在实体肿瘤中,只有特异性的免疫治疗才能真正使患者得到生存的获益。
免疫治疗:20%鳞癌转移病人有望活过10年
落实到具体疾病,陆舜教授告诉记者,特异性免疫治疗首先在实体肿瘤中是在黑色素瘤治疗上取得成功,2011年美国FDA批准了百时美施贵宝ipilimumab(抗CTLA-4单抗)上市,这是全球第一个真正意义上的肿瘤免疫治疗的药物获批上市。
自2013年美国《纽约时报》和《科学》杂志将肿瘤免疫治疗评为"重大突破"以来,肿瘤免疫治疗的热度不断攀升,在包括黑色素瘤、肺癌、胃癌、乳腺癌、卵巢癌及结直肠癌在内的几乎所有类型的肿瘤治疗都有令人惊喜的临床进展。随着研究的深入,在肺癌,肠癌,前列腺癌等领域,科学家都成功地找到另外一个免疫应答点,就是PD-1/PD-L1。抗PD-1/PD-L1免疫疗法是当前备受瞩目的新一类抗癌免疫疗法,旨在利用人体自身的免疫系统抵御癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力。陆舜教授指出,"目前包括百时美施贵宝在内有多家公司研究PD-1/PD-L1抑制剂这类药,有望成为肿瘤治疗的新基石。"
美国FDA于今年3月批准了PD-1抑制剂nivolumab用于治疗在经含铂二联化疗期间或化疗后发生疾病进展的转移性鳞状细胞非小细胞肺癌, 又于10月10日批准了nivolumab用于二线非鳞状细胞非小细胞肺癌的适应症。目前在肺癌和黑色素瘤等领域都有一些药物被美国FDA、日本、欧盟等相继批准。Nivolumab治疗非小细胞肺癌的3期临床研究将于今年在中国开展,这使得中国患者离获得国际最新肿瘤免疫治疗的日子越来越近了。
"就肺癌而言,被批准的药物是在治疗转移性鳞状细胞非小细胞肺癌方面。"陆舜教授告诉记者,"免疫治疗一旦有效,持续时间很长。这是目前我们所有的现代治疗所达不到的,一旦产生效果,将会有20%的人活过10年。而活过10年对一个转移性肿瘤患者来讲,是非常了不起的事情。"
作者: 夺标 时间: 2016-5-1 13:31
PD-L1免疫治疗药物avelumab牵手表观药物entinostat,联合治疗卵巢癌研究启动2016-1-7 作者:佚名 来源:不详 我要评论10
 Tags: 默克 辉瑞 PD-L1免疫疗法 avelumab entinostat 卵巢癌
Tags: 默克 辉瑞 PD-L1免疫疗法 avelumab entinostat 卵巢癌
分享到:[url=]0[/url]
上月底,默克(Merck KGaA)与辉瑞(Pfizer)免疫肿瘤联盟宣布启动PD-L1免疫疗法avelumab 2个新的III期临床试验(JAVELIN Ovarian 200,JAVELIN Bladder 100),前一个试验将调查avelumab治疗铂耐药
卵巢癌的潜力,后一个试验将调查avelumab作为维持疗法一线治疗尿路上皮癌的潜力。这2个III期临床试验的启动,也标志着默克-辉瑞联盟顺利完成在2015年启动avelumab 6个关键临床试验的目标。目前,双方正在一系列肿瘤类型中调查avelumab的临床治疗潜力。
2016年伊始,默克-辉瑞联盟再度发力,进一步往前推进avelumab的临床项目。近日,该联盟宣布与Syndax制药公司达成战略合作,将avelumab联合后者在研的表观遗传学药物entinostat(恩替诺特),用于先前已接受多次治疗的复发性卵巢癌患者。根据协议,Syndax将负责开展avelumab/entinostat联合治疗卵巢癌的一项I/II期临床试验。
Syndax是一家位于美国的小型生物技术公司,专注于运用表观遗传学方法克服实体瘤治疗中发生的耐药性问题。该公司的主要候选药物entinostat是一种口服的、高选择性的组蛋白去乙酰化酶(HDAC)抑制剂,针对多种类型肿瘤(包括
乳腺癌和肺癌)均表现出诱人的治疗潜力。
目前,Syndax公司已成为PD-1/PD-L1免疫治疗领域追捧的对象。除了默克-辉瑞联盟外,默沙东早在去年4月就与Syndax达成战略合作,开发PD-1免疫疗法Keytruda与entinostat联合治疗非小细胞肺癌(NSCLC)和黑色素瘤的潜力。去年8月,肿瘤巨头罗氏(Roche)也与Syndax达成合作,开发PD-L1药物atezolizumab与entinostat治疗系列肿瘤的潜力。中国国内,亿腾医药更是在2013年9月就与Syndax签订授权许可协议,获得了在中国大陆及其他数个亚洲国家和地区独家开发生产和销售entinostat的权利。
默克-辉瑞:做聪明的追随者
PD-1/PD-L1免疫疗法是当前备受瞩目的新一类肿瘤免疫疗法,旨在利用人体自身的免疫系统抵御癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力,有望实质性改善患者总生存期(OS)。当前,PD-1/PD-L1免疫竞赛非常激烈,市场峰值高达350亿美元,该领域的佼佼者包括百时美施贵宝、默沙东、罗氏、阿斯利康,其中百时美是当之无愧的的霸主。
去年11月,辉瑞与默克签署28.5亿美元协议,宣布加入PD-1/PD-L1免疫阵营。面对百时美等强敌,辉瑞与默克采取双管齐下的战略:一方面,avelumab首发针对竞争对手尚未涉及的癌症领域,如Merkel细胞癌和
胃癌;另一方面,针对对手已经涉足的领域,avelumab将做一个“聪明的追随着”,以分化试验涉及、使用生物标记物及组合疗法等方式与之争一席之地。
原始出处:
作者: 夺标 时间: 2016-5-1 13:31
SABCS 2015:PD-L1免疫治疗在三阴乳腺癌(TNBC)治疗中显示潜力(JAVELIN研究)2015-12-21 作者:MedSci 来源:MedSci 我要评论9
 Tags: SABCS 乳腺癌 PD-L1 免疫
Tags: SABCS 乳腺癌 PD-L1 免疫
分享到:[url=]0[/url]
JAVELIN研究: avelumab(摘要号S1-04)
来自匈牙利森梅威思大学的Luc Dirix教授在本次大会上报告了JAVELIN研究的结果。JAVELIN研究旨在探索PD-L1抑制剂avelumab治疗局部晚期或转移性乳腺癌患者的安全性和疗效。本项研究共入组168例患者,其中58例为三阴乳腺癌(TNBC)患者,72例为ER+/HER2-或PR+/HER2-患者,26例为HER2+患者。
结果显示,药物副作用在可接受的安全范围内,17例患者发生了免疫相关副作用,包括甲状腺功能低下、血小板减少以及自身免疫性肝炎。疗效数据显示,总有效率(ORR)占4.8%。Luc Dirix教授特别提到,在8例有效患者中有5例是三阴乳腺癌,也就是说在所有有效患者中三阴乳腺癌占到了62.5%。
进一步观察发现,PD-L1表达与疗效是否有相关性。从疗效上可以看到,在PD-L1表达阳性的患者中,有效率可以达到33.3%;而在PD-L1表达阴性的患者中,有效率则只有2.4%。另外,在5例TNBC的有效患者中,有4例是PD-L1阳性的患者。
MedSci编辑提示:
相对肺癌和黑色素瘤而言,乳腺癌中PD-L1阳性比例偏低,因此,未来PD-1/PD-L1类药物在乳腺癌中的应用可能存在局限性。但是,幸运的是,这部分人群往往是现在束手无策的TNBC。接下来,研究者们会关心如下课题:
(1)晚期或转移性TNBC中采用PD-1/PD-L1治疗,观察疗效。
(2)进一步在PD-1/PD-L1过表达的晚期或转移性TNBC中采用PD-1/PD-L1治疗,观察疗效。
(3)如果上述两个研究能证实,回答PD-1/PD-L1对于受体的选择性的问题。未来可能还是主要用于PD-1/PD-L1过表达的晚期或转移性TNBC。那么接下来,需要研究在这部分患者中,免疫治疗与化疗药物的结合(联合应用,还是序贯应用?)。实际上,一项正在进行的III期临床研究——Atezolizumab联合白蛋白紫杉醇治疗转移性三阴乳腺癌(mTNBC)正在进行中
(4)进一步,需要研究PD-1/PD-L1过表达的TNBC的一线治疗,以及一线治疗中与化疗药物的联合应用。
上述话题,将是未来5年内临床研究的热点。
作者: 夺标 时间: 2016-5-1 13:33
药界的诺贝尔奖:2015年美国盖伦奖揭晓——免疫疗法大放异彩
盖伦奖(Prix Galien Award)被公认为制药和生物医疗行业的最高荣誉,旨在褒奖医疗、科学在研究与创新领域所取得的卓越贡献,被誉为“医药界的诺贝尔奖”。美国盖伦奖(Prix Galien USA Award)自2007年开始在美国评选,包括三个奖项:最佳药品,最佳生物制品和最佳医疗器械。
获得2015年美国盖伦奖的产品如下:
最佳药品奖: IMBRUVICA(ibrutinib)
今年的最佳药品奖颁给了Janssen Biotech & Pharmacyclics的Imbruvica (ibrutinib)。
Imbruvica(ibrutinib)是一种首创的口服布鲁顿酪氨酸激酶(BTK)抑制剂,通过抑制肿瘤细胞复制和转移所需的BTK发挥抗癌作用。Imbruvica能够阻断介导恶性B细胞不可控地增殖和扩散的信号通路,帮助杀死并降低癌细胞数量,延缓癌症的恶化。
目前获批的4个适应症分别为复发性或难治性套细胞淋巴瘤(MCL)、慢性淋巴细胞白血病(CLL)、携带17p删除或TP53突变CLL、Waldenstrom巨球蛋白血症(WM)。
今年5月,生物技术巨头艾伯维(AbbVie)耗资210亿美元收购Pharmacyclics,突破性抗癌产品Imbruvica也因此收入囊中。
最佳生物技术产品奖:OPDIVO (nivolumab)&KEYTRUDA (pembrolizumab)
PD-1/PD-L1免疫疗法是当前备受瞩目的新一类抗癌免疫疗法,旨在利用人体自身的免疫系统抵御癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力。目前PD-1免疫抑制剂主要用于一线治疗及既往已接受治疗的晚期(不可切除性或转移性)黑色素瘤或转移性非小细胞肺癌患者。
虽然此次Opdivo和Keytruda同获最佳生物技术产品奖,但作为竞争对手,二者在市场上的竞争异常激烈。Keytruda仅限用于PD-L1阳性患者,而Opdivo没有PD-L1表达限制,因此在肺癌药物市场的前景更为广阔。据分析师预测,到2020年,百时美Opdivo可能以超过80亿美元的年度销售额成为PD-1抑制剂领域一代霸主,默沙东可能以50亿美元而屈居第二。
最佳医疗技术奖:T2Candida Panel
今年的最佳药品奖颁给了T2 Biosystems的 T2Candida Panel。T2Candida Panel是一种用于检测和监测念珠菌感染和败血症的诊断面板。这是首个不需要血液培养,能够在3-5小时提供特异性结果的败血症病原诊断面板,它能够帮助医生及早开始抗真菌治疗,防止疾病进展,降低感染导致的死亡风险。
作者: 夺标 时间: 2016-5-1 13:37
癌症生物免疫治疗,是敌是友?
南方周末近期发表了一篇名为《癌症免疫疗法:监管停滞 业务疯狂 国外谨慎 国内盛行》文章,引起了非常热烈的讨论。这确实是一个比较新的领域,也存在一些争议。但是就报道本身而言,其实还存在一些瑕疵,在具体事实的描述上存在偏差,对这个问题的一些深入把握也很不够。因此,值得再细细地讨论一下这个问题。
随着肿瘤发病率的逐年提高,人们对抗肿瘤治疗的关注日益增加。寻找一种高效、无毒的方式治疗恶性肿瘤无疑是医生和患者共同的梦想。人体免疫系统是保护机体不受外界疾病侵袭的关键保障。因此,利用人体自身免疫功能展开的抗肿瘤治疗成为焦点所在。
近年来,国内外免疫治疗发展迅猛,被认为是继手术、放射治疗、化学治疗之后,对肿瘤有明确效果的又一重要治疗方法,广泛应用于多种恶性肿瘤的治疗。同时,也确实存在报道中所称的“国家管理混乱,没有政策引导”的状况,这就导致了很多团体打着癌症最新疗法的旗号,招摇撞骗,牟取暴利。但是,报道称目前全国几乎所有三甲医院都在开展这种疗法。其实不然,就北京而言,像北京肿瘤医院等肿瘤专科医院和市属三甲医院都未开展这项治疗。
所谓细胞免疫治疗,通俗的说就是通过体外方式补充或者强化体内原有的免疫系统,从而让免疫系统强大到足以杀死肿瘤细胞。人体的免疫系统成份十分复杂,就像一个国家的军队分为陆军、海军、空军等很多兵种,但共同的使命是保卫人体不受疾病侵害。一个国家强军的方式可以通过增加军人数量、配备优良装备、加强训练、增强各个兵种之间的协作等多种多样的方式来实现。
十分类似的是,癌症免疫治疗也可以通过不同手段提高免疫系统效力。但是细胞免疫疗法是一类疗法,而不仅仅是一种。根据对免疫系统不同成份的补充以及强化的方式不同,肿瘤免疫治疗也被分为很多种类,包括淋巴因子激活的杀伤细胞、肿瘤浸润淋巴细胞、细胞因子诱导的杀伤细胞、树突状细胞、共培养免疫( DC-CIK) 细胞、自然杀伤细胞型的淋巴细胞,等等。而报道中所称的“通过抽取患者的免疫细胞,在体外扩增和加工,并重新输回患者体内,从而达到提高患者免疫能力,抑制或预防肿瘤生长的目的。”的这种方法只是众多免疫疗法中的一种,被称为DC-CIK。也确实是国内市场上最流行的一种细胞免疫疗法。然而报道中有多处混淆了细胞免疫疗法和DC-CIK疗法的概念,将两者混为一谈,其中“免疫细胞疗法在全世界都仅是临床研究”、“FDA没有通过任何细胞免疫疗法”这样的说法,是有失偏颇的。
那么肿瘤免疫治疗是否有效呢?答案是:正如上文所说,肿瘤免疫治疗包括很多种类,其中的一些方法,在一些具体的适应状况下,确实是有一定疗效。2010年美国FDA批准首个治疗性肿瘤疫苗Provenge(细胞免疫疗法中的一种)用于治疗晚期前列腺癌,经过临床实验表明这项治疗可以延长患者生命四个月。2011年FDA又批准了负向共刺激因子抑制剂的单克隆抗体易普利姆玛单抗(ipilimumab),用于治疗转移性黑色素瘤,并取得良好的治疗效果。今年5月实验性PD-1免疫检查点抗体nivolumab突破性疗法也被FDA认定可用于治疗自体干细胞移植和brentuximab失败的霍奇金淋巴瘤(HL)患者的治疗。值得注意的是,目前细胞免疫治疗并不是对所有患者、所有肿瘤都有疗效。肿瘤免疫治疗临床疗效与患者体内的肿瘤体积大小、治疗时机、免疫细胞细胞数量与活性、输入人体途径密切相关。因此,对不同病人、不同病种、不同分期的肿瘤疗效也不尽相同。因此我们针对一类肿瘤去讨论一个疗法的有效性显然意义不大,而盲目的说免疫细胞疗法对肿瘤根本无效也确实不科学。
尽管这些方法在美国这样的发达国家的研究历史已达十余年,其中一些方法也逐渐取得新进展并得以获批,但目前我国却没有相关的审批途径和管理规范,再加之其中巨大的经济利益,使得细胞免疫疗法在临床中的一些混乱局面长期存在,甚至有愈演愈烈之势。那么,为什么中国没有相关的审批途径和管理规范呢?其实,对于免疫细胞疗法的审批和监管本身也存在着一定困难,这是由于免疫治疗自身的特点决定的。
免疫治疗利用的是人体正常的免疫机制及免疫细胞,而不是某种药物。因此不能通过目前医学界广泛认可的临床实验方式来验证其疗效和毒性。由于每个患者的免疫系统都存在差别,每种肿瘤都会对患者免疫系统造成不同方面影响从而达到使肿瘤细胞逃过免疫组织监察的目的,所以同一种免疫治疗对于不同个体、不同肿瘤疗效当然不同。同时,不同免疫细胞在体外激活后又被输入体内,其“量”和“质”难以用统一标准衡量,因此免疫治疗的质量控制十分困难。正是由于上述种种原因,中国医药卫生部门目前才对这种疗法没有明确管理标准和审批流程。
对于每一位肿瘤患者和家属而言,切不可盲目的被广告欺骗,在经济损失惨重的同时,耽误正规有效的治疗。但是也不要因为目前国内生物免疫疗法的混乱的局面而全盘否定这种疗法的治疗效果。都要本着理性科学的态度看待这种治疗方式,把它作为肿瘤标准手术、放疗、化疗的等治疗方式之外的有利补充,针对不同患者、不同肿瘤、不同疾病时期,因时因地制宜,在综合治疗的框架下有选择的使用,才能明辨敌友,令患者获益。
对于国家的审批和监管部门而言,面对如此混乱的局面,只是宣称没有批准免疫细胞疗法在临床的应用显然是不够的。一方面,在研究能力已具备的情况下,尽快出台相应的审批政策使得该项疗法合法化自然是缓解目前市场混乱的一个办法。但是在目前无法审批的情况下,加强监管,取缔不法医疗行为也是卫生部门不可推卸的责任。
作者: 夺标 时间: 2016-5-1 13:40
几种常见细胞治疗肿瘤技术:CART和NK细胞技术,其中taNK闪耀前景
免疫疗法是利用免疫系统来治疗疾病的一种概念:包括基于T细胞、B细胞及自然杀伤细胞(NK)等免疫细胞疗法。目前在CAR-T免疫疗法领域,除诺华及Juno外,其他跟进者包括Kite、基因治疗先驱蓝鸟生物(Bluebird bio)、生物技术巨头新基(Celgene),这些公司的细胞治疗技术皆是以T细胞为核心。
一、CAR-T细胞
CAR-T,全称是Chimeric Antigen Receptor T-Cell Immunotherapy,嵌合抗原受体T细胞免疫疗法。这是一个出现了很多年,但是近几年才被改良使用到临床上的新型细胞疗法。在急性
白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
第一代CAR介导的T细胞激活是通过CD3z链或FceRIg上的酪氨酸激活基序完成的。CD3z链能够提供T细胞激活、裂解靶细胞、调节IL-2分泌以及体内发挥抗肿瘤活性所需的信号。但第一代CAR改造T细胞的抗肿瘤活性在体内受到了限制,T细胞增殖减少最终导致T细胞的凋亡。第二代CAR在胞内增加了一个新的共刺激信号,实验证明,这使得原有的使源自TCR/CD3复合体的“信号1”扩大,许多研究都表明,搭载了“信号2”的第二代CAR与第一代CAR相比,抗原特异性不变,T细胞增殖、细胞因子分泌增加,抗细胞凋亡蛋白分泌增加,细胞死亡延迟。常用的共刺激分子为CD28, 但之后有研究将CD28用CD137(4-1BB)进行替换,除此之外,一种使用NK细胞受体CD244的思路也被提出来。虽然不同的第二代CAR究竟孰优孰劣,不同的研究者用不同的肿瘤在体内和体外的研究中得到的结果不尽相同;但与第一代CAR相比,这种设计能够增加对肿瘤细胞裂解的记忆效应以及CAR介导的杀伤效应。
为了进一步改良CAR的设计,许多研究组开始着眼于发展第三代CAR,不仅包括“信号1”、“信号2”,还包括了额外的共刺激信号。不同研究者们用不同的靶点和共刺激信号开展的研究所得到的第二代CAR和第三代CAR的比较结果存在一定的差异性。一些研究报道表达第三代CAR的重组T细胞在抗肿瘤活性、存活周期及细胞因子释放方面均显著提高;Wilkie等的研究结果显示靶向MUC1的第二代CAR与第三代CAR重组T细胞在抗肿瘤细胞毒性方面并无明显差异,虽然表达第三代CAR的T细胞能够分泌更大量的IFN-γ(Wilkie S, Picco G, Foster J, et al. Retargeting of human T cells to tumorassociated MUC1: the evolution of a chimeric antigen receptor. J Immunol 2008; 180: 4901–4909.)。值得注意的是,上述区别仅仅是体外实验中获得的结论,目前尚未在体内比较第二代和第三代CAR的报道。这两代CAR之间的差异可能不止来自于信号传导域,胞外的抗原结合域(scFv)、重组T细胞的转染方法(慢病毒VS逆转录病毒)、重组T细胞的回输方式(静脉回输VS腹膜VS瘤体)等均可能影响CAR-T细胞的最终抗肿瘤效果。
最近一例采用通用的CAR技术制备的CART成功救治一例复发性白血病成功,标志着CART技术由个性化制备向通用CART细胞治疗迈进。
二、NK细胞
全球知名医生陈颂雄创办的NantKwest也在今年上市。根据该公司官网的介绍:其主要以自然杀伤细胞(natural killer cell,NK)治疗为核心,拥有三大技术平台——aNK、haNK和taNK。众所周知,NK细胞不仅是机体重要的免疫细胞,不仅与抗肿瘤、 抗病毒感染和免疫调节有关,而且在某些情况下参与超敏反应和自身免疫性疾病的发生。
aNK、haNK和taNK三大技术平台与当前备受追捧的CAR-T技术平台有何异同呢?
1、Activated Natural Killer "Off-The-Shelf" Cell:The aNK Cell
第一步:将aNK细胞绑定受体;第二步:激活颗粒酶;第三步:释放颗粒酶。The aNK Cell是NantKwest的当家平台,也是后面两种平台的基础,,aNK(Activated Natural Killer)包括重要的“A-A-A”步骤,即Adhesion(粘附)——Activation(活化)——Apoptosis(凋亡)。
杀伤细胞抑制性受体在功能上类似于T细胞表面的程序性死亡受体1(PD-1),都可以抑制细胞信号通路,PD-1通路的配体为PD-L1,后者是肿瘤细胞的防身利器,CAR-T对实体瘤效果不佳,很大程度上就因为肿瘤细胞高表达的PD-L1抑制了T细胞活性。aNK不表达杀伤细胞抑制性受体( Killer Inhibitory Receptors,KIR),进而避免自己被靶细胞表面的主要组织相容性复合体(MHC)抑制活性。
aNK Cell经过敲除KIR的改造后,犹如多了一层“防护罩”,即使它进入了肿瘤浸润区域,也可以很轻松躲避肿瘤的抑制信号,保持满满的能量去消灭肿瘤细胞;而Juno、Bluebird的CAR-T倘若没有如此防护罩直接裸奔到肿瘤浸润区域,或将因PD-L1的存在而失去作战力。
off-and-shelf 治疗标准操作流程
技术点评:由上图可见,独特的aNK 细胞平台(off-and-shelf 治疗)不同于一般的NK 细胞的独特之处在于不表达杀伤抑制受体(KIR)。而KIR恰恰是癌细胞经常利用用以逃避NK 细胞杀伤的受体;同时,aNK细胞还携带颗粒酶和含有穿孔颗粒的较大有效负载,从而使其能针对多靶点提供致死酶有效负荷。另外,公司的生产专利、递药系统保证了aNK细胞可以按需要商业化生长,就像“在袋子里的活药”。aNK细胞的安全性已经在几十个I期临床(针对恶黑和实体瘤)中得到验证,其安全性、活性和对生存期的延长已经证实。
2、Antibody Mediated Cell Killing by high-affinity Natural Killer cells:The haNK Cell
被高亲和性自然杀伤细胞杀死的抗体介导细胞(haNK)可以扩大aNK的应用范围,对接并提高那些对抗体依赖性的细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)发挥功能的抗体的疗效。
HaNK如何发挥自己作用的?
抗体发挥作用的一个重要机理是ADCC,即抗体依赖Fc(对免疫球蛋白Fc部分c末端的受体)同NK细胞的CD16结合招募并激活NK到肿瘤靶细胞处对肿瘤细胞进行清除,例如我们熟悉的重磅单抗药物——赫赛汀、美罗华都依靠ADCC发挥作用。
抗体就是士兵,而自然杀伤细胞(natural killer cell,NK)是武器(军火),赤手空拳的士兵很难在同肿瘤对抗中获胜。haNK cell通过改造表现的CD16,直接提升了对Fc的亲和力,即为赫赛汀、美罗华类的抗体打造了拿手武器。
因此haNK细胞是一种对抗肿瘤的通用“武器”,相同的haNK cell配合已上市的不同抗体药物联合使用,用于治疗不同的疾病。所以未来使用赫赛汀、美罗华时,医生或许会建议你带上haNK细胞,杀伤力更强。
技术点评:haNK可提高CD16亲和力,若依赖T细胞的CAR-T若是对CD3进行改造,毅然也可增强自身对抗肿瘤的能力。
3、Target-Activated Natural Killer Cell:The taNK Cell
靶向活化自然杀伤细胞(taNK Cell)近乎模仿CAR-T的嵌合抗原受体(CAR)技术:通过嵌合在NK细胞表面的肿瘤特异性抗体,靶向识别并摧毁肿瘤细胞;不同的是,taNK敲除了KIR相当于拥有“防护罩”,CAR-T是“裸奔”。
taNK细胞在3秒内攻击HER2过度表达的转移性
乳腺癌细胞
技术点评:aNK、haNK和taNK技术平台具有敲除抑制信号通路的概念,概念上较为领先CAR-T;不过相对于众多CAR-T来说,NK细胞治疗相对还是稀缺资源。由于传统的非特异性免疫治疗(NK、DC、CIK、DC-CIK)没有足够的临床数据证明其在延长癌症患者五年生存率方面有显著的改善,全球的研发基本也抛弃了这项起源于上世纪90年代的技术,转而侧重特异性免疫治疗(以T 细胞为核心,包括ACT、CAR-T、TCR 等)。但是随着基因编辑技术的发展和成熟,人类对NK细胞的改造或将在对抗癌细胞上具有更强的摧毁力。
当然,最近还在体内发现一种同时具有NK细胞和T细胞双重特性的细胞NKT,它对肿瘤具有更高特异性杀伤作用,在体内分布极少。不过未来有望也可以被改造成为重要的免疫治疗细胞之一。
作者: 夺标 时间: 2016-5-1 13:41
SITC 2015:聚焦国际肿瘤免疫治疗前沿趋势2015-11-7 作者:MedSci 来源:MedSci 我要评论9
 Tags: 肿瘤免疫 治疗
Tags: 肿瘤免疫 治疗
分享到:[url=]0[/url]
2015年第30届癌症免疫治疗协会年会(SITC)于11月4日-8日在美国——马里兰州——国家港口召开;
CAR-T细胞治疗现状:安全性及疗效
肿瘤免疫疗法的疗效评价
Public Accessto CBER
结论:
1.新的治疗方法带来新的监管挑战;
2.个体化治疗(精准治疗)需要新的临床development paradigms;
3.肿瘤缩小(反应率)或许不能真正预测临床获益;
4.基因修饰T细胞,扩增,目前剂量,安全性挑战。
基于基因/细胞的肿瘤治疗产品(2009-2014)
作者: 夺标 时间: 2016-5-1 13:43
CAR-T疗法发明者Carl H. June演讲:决胜癌症的CAR-T治疗
今年年初,伦敦大学的科学家也在皇家学会癌症研讨会上表示,到21世纪中叶,人类有望实现“没有80岁以下的人死于癌症”。当然,这些人的豪言壮语并非是口若悬河。
近几年,科学家在肿瘤免疫治疗领域的突破,足以让大家有底气相信上述那些话语。说起免疫治疗,目前主要有两大令人振奋的最新成果,一类是免疫检查点阻断治疗,包括针对T淋巴细胞抗原4(CTLA-4)的抗体(Ipilimumab)和针对CD8阳性T细胞的程序性死亡因子PD1/PD-L1的抗体;第二类就是以CAR-T细胞技术为主的过继性免疫治疗(被动免疫),包括LAK细胞、CIK细胞、CTL细胞、TIL细胞等。
CAR-T也称为嵌合抗原受体T细胞技术。CAR-T虽然并不是一个完全新鲜的事物,但是近几年改良的CAR-T技术作为一种新型细胞疗法成功应用于癌症的临床治疗。而那个幸运的小女孩Emily Whitehead,请大家记住她的笑脸,因为她将永远被载入人类与恶性疾病战斗的史册。在CAR-T技术出现以前,传统的药物治疗目标主要是“延长病人的寿命”,通常的指标是“1年存活率”“5年存活率”云云,谁也不敢奢望把癌症治愈。然而CAR-T的出现,让人类看到了彻底治愈癌症的曙光,我们终于能大声地说“滚蛋吧!肿瘤君”。
幸运女孩Emily Whitehead
CAR-T疗法的现状:世界与中国
小编通过clinicaltrials.gov网站,以“chimeric receptor”为关键词进行在线搜索,大致可为大家展示全世界CAR-T临床工作开展的整体情况。目前,我们能检索到的临床数量有122项,其中美国共有77项、中国有24项临床实验、欧盟共有16项、中东2项、日本、东南亚和澳大利亚各一项。中国已经成为全球第二大开展CAR-T临床研究的国家,看到这里,大家是不是还有点小激动呢。然而中国在CAR-T领域的飞速发展远不止如此!美国是最早开展CAR-T临床实验的国家,2010年前全球的CAR-T注册临床实验都集中在美国。2011年,欧洲也开始CAR-T临床注册,至2013年起,中国301医院也加入CAR-T临床研究的大军。至此中国CAR-T项目注册数逐年递增,到2015年11月,中国注册的CAR-T临床数目已经超过美国,达到全年新注册的CAR-T临床总数的50%。
然而关于中国的CAR-T研究,在火热的背后我们应警惕一些问题的出现。不可否认,中国的科研土壤并不那么“纯粹”,目前如此大规模的上马CAR-T项目,最大的问题是如何保证研究的质量。有关部门应当做好监督作用,杜绝一些并没有CAR-T研究实力而盲目跟风的科研机构和医院。此外,中国的CAR-T研究一定要做好有价值的专利申请,并且积极参与国际CAR-T标准的制定。不然你的CAR-T技术再好,在今后的商业应用方面永远受制于人,诸如此类的哑巴亏我们已经吃的够多了。
截止到2015年12月12日的全球CAR-T临床注册项目地区分布
目前,全球的科研人员更倾向于CAR-T在血液肿瘤(
白血病和淋巴瘤)方面的治疗研究,血液肿瘤能充分发挥CAR-T的优势,而实体瘤中,CAR-T较难以进入肿瘤内部,因此杀伤效果目前较为有限。在免疫非常敏感的黑色素瘤中,效果很明显,而在其它实体瘤中还正在探索。
在现有的CAR-T临床实验中,最常见的靶点仍然是CD19,全球共有59项临床实验选择CD19作为靶点,这与CAR-T临床偏好血液肿瘤的情况一致。其余研究较多的靶点有Her2(7项)、GD2(7项)、CEA(6项)、mesothelin(5项)。此外,全球的临床研究主要还是以第二代CAR-T技术为主,其中主流的共刺激因子为4-1BB和CD28。所有的项目中,采用三代/四代技术的项目占总数的比例不到10%。而中国和美国可能是目前全世界唯一进行四代CAR-T临床实验的国家。
不过,不过不要误解,四代的疗效就优于二代或三代,只是靶点和技术有差别而已。
以CD19为靶点的典型二代CAR-T技术
CAR-T联合CRISPR可能会带来新的突破
虽然CAR-T离最后的商业化应用还有些时日,不过CAR-T研究领域的顶尖企业诺华制药(Novatris)却未雨绸缪,其在今年年初投资了专攻CRISPR技术的新兴公司Intellia Therapeutic,两者将合作开发最有前途的新药。然而就在诺华的投资仅仅过去几个月,CAR-T新贵Juno Therapeutics就与Editas Medicine达成7.37亿美元的合作协议,准备结合CRISPR技术共同开发癌症免疫疗法CAR-T和TCR(high-affinity T cell receptor)。去年,Juno与诺华已经对部分CAR-T相关的专利纠纷达成和解,不过看来这两家企业又想在CRISPR技术上开辟第二战场。
而且他们投资的这两家CRISPR技术公司的背景又非常耐人寻味,Intellia背后有着CRISPR女神 Jennifer Doudna的身影,而Editas Medicine则是张锋的后花园。Doudna早先是Editas的联合创始人,后来也是由于专利的问题脱离了最初的团队,并将自己的知识产权授权给了Intellia Therapeutics。最终,这场逐鹿中原的游戏变成了“诺华+Jnnifer Doudna ”PK“JUNO+张锋”。
Jnnifer Doudna和张锋
CAR-T的明天
虽然现在CAR-T治疗还没有完全进入商业化阶段,不过CAR-T技术的发明者卡尔教授表示,CAR-T技术2010年开始做第一次临床实验,估计2017年通过美国
FDA审批,只用7年的时间,这样已经是很快了。
目前严重的免疫反应是CAR-T疗法最大的副作用--细胞因子风暴(CRS),表现为高热。但是如果没有CRS的话,也就意味着没有治疗效果,所以副作用是治疗过程的一部分,我们需要解决的是如何控制这个副作用。针对这个问题,今年9月发表在《科学》杂志上的一项研究中,加州大学旧金山分校的研究员设计出一个能够严格控制T细胞行为的“分子开关”,这一突破成果有望解决T细胞治疗严重副作用的重大障碍。这一研究颠覆性的开发了“沉默”CAR-T系统,能精确地使CAR-T细胞行使完它的使命后自行凋亡,大大缓解了严重的副作用,诚然使CAR-T免疫治疗的有效性和可靠性提升到一个新的高度。
现阶段,CAR-T疗法还面临诸多技术挑战,例如CAR-T治疗过程自动化和流程化,异源CAR-T的应用,CAR-T在实体瘤中的应用等,最终这些技术突破,才使CAR-T广泛应用。最后我们相信,这一天的到来不会让世人等太久!
作者: 夺标 时间: 2016-5-1 13:44
CAR-T疗法发明者Carl H. June演讲:决胜癌症的CAR-T治疗2015深圳国际BT领袖峰会上,被获评为“全球生物制药界最有影响力的科学家”、美国科学院院士、美国宾夕法尼亚大学终身教授卡尔·朱恩(Carl H. June),发表主题为“决胜癌症:癌症的CAR-T治疗”的演讲。
卡尔·朱恩(Carl H. June),美国科学院院士,现任美国宾夕法尼亚大学Perelman医学院病理系终审教授,Abramson家族癌症研究所转化医学中心主任。Carl H.June教授是CAR-T技术的发明者,迄今已发表超过360篇
SCI论文,申请专利46项,授权31项。其中,很多文章发表在新英格兰杂志上(见附录)
以下为演讲实录:
在这里我想给大家介绍一下我们的CAR-T细胞疗法,我想给大家介绍一下,我研究中运用的新疗法,我自己的实验室是在宾夕法尼亚州,我们研发的一些疗法也是会基于这个实验室进行。作为在医疗健康行业的进步,我们在过去几年,尤其是一些年轻人和年老人身上都发现由于癌症带来的一些心血管的疾病,但是我们在一些学界的研究中,可以看到对于癌症的治疗也将会成为我们在未来健康花销中非常重要的一部分,我们要找到一些疗法是非常重要的,这样才能降低我们对抗癌症上面带来的一些医疗费用。
大家可以看到这是由于癌症的死亡率,死亡率相当高,中国也是如此。过去我们有一个所谓的战胜癌症,癌症的存活率,可以看到现在的曲线已经急剧下滑,对于很多癌症的诊断来说,许多都是由肿瘤开始,最近可以看到有一些疗法毒性并不是那么高,可以提高几个月的存活率,其他的免疫疗法需要有一些介入式的疗法,有很强烈的复发性,大家可以看一下这个期限,这就是我们所说的,我们在免疫疗法和治愈疗法中非常重要的疗法,我们希望能找到更高的治愈率,降低复发的目标。
我们可以看一下在癌症的免疫疗法里,一直都是我们在过去一百年里希望能做到的发展,而在这几年,其实才取得了长足的进步,我们使用一些抗体、PD1、PD-L1做到这一点,待会儿我也会讲一下自体基细胞,很多研究专家和科学家现在有了一些免疫疗法的初期想法,我们在这里主要用靶向细胞,如果是一个病人有靶向细胞可以杀死癌症的肿瘤细胞,在化疗之后,如果有一些抗体的话,我们就能进行调整。在这里的CAR-T靶向细胞不会杀死正常的细胞,五天就可以形成抗体,这个CAR-T细胞,我们2010年开始治疗一些临床的研究。
五年之后,他们接受治疗以后体内还有T型细胞,以后他们的人生中,我们看到可能会再次的复发,这里面他们体内的免疫系统希望寻求更多的办法对抗癌症,这种T细胞,每个能杀死一个肿瘤细胞,它就是我们所说的癌症细胞的连环杀手,如果是一位成人的话,2010年的时候注射了培养的一些靶向细胞的话,在这里面的方法要比其他的方法更有用。
我们一开始的做法就是先去从他的血液里面取出一些白细胞,在实验室里进行培养,五天内就可以培养成型,单一的血液注射,重新注入到病人的体内,2011年的4月,我们可以看到在一些晚期的肿瘤患者和癌症病人的治疗中,我们也可以看到里面的重要性,在他们体内的T型细胞能够杀死肿瘤细胞,我们可以把这种细胞叫做肿瘤细胞的连环杀手。
五年以后,这一系列的疗法在早期接受试验的病人体内还能继续实现,在细胞的表面实现一些抗体,这样的话,能够通过两到三个星期进行重新的治疗。在医疗工程上就能看到一些困扰,病人体内是否可以成为生产这种细胞的源泉、制造地呢?我们首先可以看到,他们首先会去接受一些比较难治的,他们有一些慢性的细胞,淋巴细胞
白血病以及一些其他的癌症表征。
我们所说的淋巴细胞治白血病,它们的存活率是10%,两年之后还有10%的存活率。去年我们的报告,实现了50%完成缓解CR,这是很少在单一的机构里,一期临床试验出现这个结果,这是多中心的实验,这是诺华赞助的,包括基于我们现在的结果等待,包括
FDA的批准,最早方案的治疗是非常知名,这是一个患者当时只有6岁,她成为非常知名的例子。
2012年到现在已经有两年多了,我们也可以看一下,纽约时报2012年登了她的封面,这也是做了一系列的恢复,我们也可以通过一个短片看到。
她也成为当时风靡一时的偶像,奥巴马3月1号宣布精准医疗的方案,我们知道习主席和奥巴马总理正在见面,代表中美之间非常良好关系进一步的发展,我们现在来看一下总体医疗方面的挑战,我们有三大挑战,一个是制药行业;二是生物技术;三是医疗器械、医疗设备。
我们现在正在不断改变这场革命,我们在打造第四道支柱,第四道支柱代表细胞治疗和其他我今天展示的新的治疗方案,我们现在面临着重重挑战。可能和其他的药物不一样,有的时候具有患者特异性,我们希望能找到一些更为普适性的细胞,能代表每个患者,背后还有一个未知数,他们可能有的时候是属于要找到本地的血库模型,还要找到一些当地不同的法规是不是能满足相关的需求。2014年的时候福布斯杂志有一篇知名的文章,文章也就是宾大和诺华的联盟,希望提出一些癌症的治疗疗法,希望得到美国FDA的批准,FDA也做出了突破性的文件,现在是多中心的临床实验,现在是在美国,未来还会向日本和其他地区开放,预期明年从日本开始。
有的时候你一生只有一个机会,美国医疗保险的体系能让患者,每一次来到医院里可以得到报销的覆盖,可能视作像疫苗一样,一次性注射,一劳永逸,不希望再重复治疗,我们也在做一些相关的研究,能让药物的疗效更好,并且能持续很长的时间。
有关CAR-T的抗原受体细胞在全国有77个大大小小的临床实验正在进行,它覆盖很多不同的地方,最多的是美国有48个临床实验,中国第二位,中国有20个相关的临床试验,还有八个在欧洲地区,中国在不断开发、制定标准,欧洲也在努力的赶上。日本和澳大利亚、亚太地区只有一个。
最开始只有一系列非常有限的学院机构关注,现在已经成为备受关注的新领域正在发展,让学术机构、研究机构,无论是来自美国和中国的机构正在积极的参与。我们希望有更多的人,还有一个美籍华人,我上次见到过他,我问他癌症怎么样,他说他的肌肉很痛。在得到治疗之后,他已经想要成为一个棒球手。一旦有机会我们能获得免疫治疗的成功、获得疗效,他们能回到正常的生活,不会再受到病魔的折磨,非常高兴来到深圳,非常感谢大家。
Carl H. June研究成果
Garfall AL, Maus MV, Hwang WT, Lacey SF, Mahnke YD, Melenhorst JJ, Zheng Z, Vogl DT, Cohen AD, Weiss BM, Dengel K, Kerr ND, Bagg A, Levine BL, June CH, Stadtmauer EA.
Chimeric Antigen Receptor T Cells against CD19 for Multiple Myeloma.N Engl J Med. 2015 Sep 10;373(11):1040-7.
Porter DL, Hwang WT, Frey NV, Lacey SF, Shaw PA, Loren AW, Bagg A, Marcucci KT, Shen A, Gonzalez V, Ambrose D, Grupp SA, Chew A, Zheng Z, Milone MC, Levine BL, Melenhorst JJ, June CH.
Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia.Sci Transl Med. 2015 Sep 2;7(303):303ra139
Rapoport AP, Stadtmauer EA, Binder-Scholl GK, Goloubeva O, Vogl DT, Lacey SF, Badros AZ, Garfall A, Weiss B, Finklestein J, Kulikovskaya I, Sinha SK, Kronsberg S, Gupta M, Bond S, Melchiori L, Brewer JE, Bennett AD, Gerry AB, Pumphrey NJ, Williams D, Tayton-Martin HK, Ribeiro L, Holdich T, Yanovich S, Hardy N, Yared J, Kerr N, Philip S, Westphal S, Siegel DL, Levine BL, Jakobsen BK, Kalos M, June CH.
NY-ESO-1-specific TCR-engineered T cells mediate sustained antigen-specific antitumor effects in myeloma. Nat Med. 2015 Aug;21(8):914-21
Maude SL, Frey N, Shaw PA, Aplenc R, Barrett DM, Bunin NJ, Chew A, Gonzalez VE, Zheng Z, Lacey SF, Mahnke YD, Melenhorst JJ, Rheingold SR, Shen A, Teachey DT, Levine BL, June CH, Porter DL, Grupp SA.
Chimeric antigen receptor T cells for sustained remissions in leukemia.N Engl J Med. 2014 Oct 16;371(16):1507-17.
Tebas P, Stein D, Tang WW, Frank I, Wang SQ, Lee G, Spratt SK, Surosky RT, Giedlin MA, Nichol G, Holmes MC, Gregory PD, Ando DG, Kalos M, Collman RG, Binder-Scholl G, Plesa G, Hwang WT, Levine BL, June CH.
Gene editing of CCR5 in autologous CD4 T cells of persons infected with HIV.N Engl J Med. 2014 Mar 6;370(10):901-10
Grupp SA, Kalos M, Barrett D, Aplenc R, Porter DL, Rheingold SR, Teachey DT, Chew A, Hauck B, Wright JF, Milone MC, Levine BL, June CH.
Chimeric antigen receptor-modified T cells for acute lymphoid leukemia.N Engl J Med. 2013 Apr 18;368(16):1509-18
Liddy N, Bossi G, Adams KJ, Lissina A, Mahon TM, Hassan NJ, Gavarret J, Bianchi FC, Pumphrey NJ, Ladell K, Gostick E, Sewell AK, Lissin NM, Harwood NE, Molloy PE, Li Y, Cameron BJ, Sami M, Baston EE, Todorov PT, Paston SJ, Dennis RE, Harper JV, Dunn SM, Ashfield R, Johnson A, McGrath Y, Plesa G, June CH, Kalos M, Price DA, Vuidepot A, Williams DD, Sutton DH, Jakobsen BK.
Monoclonal TCR-redirected tumor cell killing.Nat Med. 2012 Jun;18(6):980-7
作者: 夺标 时间: 2016-5-1 13:45
免疫疗法CAR-T的“江湖人生”
人生小哲理
当我退役的时候,我希望回头看我走过的路,每一天,我都付出了我的全部!“
——科比·布莱恩特
肿瘤治疗是一块难啃的硬骨头,人们总是费劲脑汁想要攻破。传统的化疗给患者带来了无比的苦楚,副作用更不说。当肿瘤免疫疗法突破那道防线出现在人们眼前的时候,一切都变成了“有可能”。技术的不断更替也使得CAR-T的江湖地位越来越稳固。
CAR-T 的“江湖人生”

2014年6月,只有19名员工的Kite生物技术公司在美国纳斯达克上市,一天之内狂揽1亿3千万美金!仅仅过了两个月,同样不到20人的Juno生物技术公司对外宣布,成功一次性融资1亿3千万美金,这样Juno一年之内已经融资超过3亿!这两个小公司没有任何收入,没有一个上市的药物,凭什么如此受投资人的欢迎,而纷纷向它们送钱?
CAR-T治疗的临床研究开始于2010年,当时CAR-T的发明人,宾夕法尼亚大学教授Carl H. June利用CAR-T治疗成功缓解了三位淋巴细胞白血病患者。其中有两位患者现在还很健康,没有复发的迹象。2012年,June利用还处于临床I期的CAR-T治疗技术,成功挽救身患急性淋巴细胞白血病已经无药可医的7岁小姑娘Emily Whitehead。Whitehead 是第一个接受CAR-T治疗的儿童。至此CAR-T一战成名。
美国各大分析机构预测,基于CAR-T疗法的肿瘤治疗市场空间可能达到350亿美元-1000亿美元;国内市场乐观估计的话可能达到1000亿人民币。2015年12月,诺华在第56届美国血液学会年会(ASH)上公布,CAR-T细胞疗法CTL019在2期r/r ALL临床试验中获得93%的完全应答率。
好吧,如此大的市场空间,以及对癌症的疗效之好,怪不得各路豪杰的争先追捧,都想将其取回自己的家门,为自己”生(zhuan)儿(qian)育(yang)女(jia)”。
CAR-T 的“霸王之战”

话说是“金子总会发光”!但CAR-T可不仅仅是块“会发光的金子”,而是…
在此,我也没有过多的精力来翻看CAR-T霸主之战的陈年老账,只列举近来的事件吧。
1、5000万美元!Celgene携手Juno深化CAR-T治疗研发合作
Celgene和Juno达成一项靶向CD19的CAR-T研发合作,交易金额达5000万美元。根据协议,Celgene将获得该项目在欧洲地区、北美和中国之外地区的研发和商业化权利,而Juno仍保留在北美和中国的商业化权利。
去年6月份,Celgene与Juno达成了为期10年、金额高达10亿美元的CAR-T全球合作研发协议,高调入主肿瘤免疫领域。本次合作将会帮助Celgene进一步强化在CAR-T治疗领域的地位,当前该领域的强劲对手是诺华和Kite。
2、5800万!中源协和买进血液研究所的CAR-T制备技术专利
中源协和4月11日发布公告,将自筹资金 5800 万元从中国医学科学院血液病医院(血液学研究所)购买一笔无形资产——用于治疗急性白血病等血液肿瘤疾病的嵌合抗原受体 T细胞(CAR-T)制备技术,包括CD19-CAR-T 及CD33-CAR-T两项专有技术及依托于该技术申请的相关专利。专利申请号分别为:【201510233748.0】和【201510362934.4】。
3、Juno联手药明康德,创新肿瘤细胞免疫疗法的开发
近日,药明康德联手肿瘤细胞免疫治疗巨头Juno成立新公司——上海药明巨诺生物科技有限公司(JW Biotechnology Co. Ltd)。结合Juno世界领先的嵌合抗原受体技术CAR-T和T细胞受体技术TCR-T,以及药明康德的研发平台和中国市场,打造中国领先的细胞治疗公司。
根据协议,药明康德和Juno公司将对药明巨诺拥有同等股权。药明巨诺实现发展里程碑后有权选择Juno产品线在中国进行开发和商业化;为此Juno公司将获取相应预付款或相当股权、里程款以及销售提成。
4、Baxalta牵手基因编辑公司Precision,开发新型CAR-T疗法
Baxalta公司与基因编辑公司Precision BioSciences宣布达成合作,开发基于健康供体T细胞的新型嵌合抗原受体T细胞免疫疗法(CAR-T),以用于多种癌症的治疗。根据协议,双方将选择六个肿瘤靶点进行开发合作,并计划在2017年下半年将第一个候选疗法推进临床阶段。Precision BioSciences将主要负责II期临床及之前的研发工作,Baxalta则将主导后期开发和商业化的工作,并支付相应的里程碑款项,涉及金额总计约16亿美元。
Precision 提出,通过运用其开发的ARCUS基因编辑技术,对取自健康个体的T细胞进行改造,使之可用于癌症患者的治疗。这样,我们就可以有随时可用、足够数量的T细胞作为CAR-T疗法的“原料”,从而给癌症患者提供快速而有效的治疗。
5、罗氏牵手Kite,CAR-T疗法与PD-L1“珠联璧合”
3月18日,据FierceBiotech报道,罗氏与Kite Pharma达成合作交易,共同开发前者PD-L1药物atezolizumab与后者CAR-T疗法KTE-C19针对难治性、侵袭性非霍奇金淋巴瘤患者的联合疗法
6、基因、细胞大爆发 英国设定150亿美元的基因和细胞治疗产业目标
据Stephen Ward博士说,英国已经定下产值高达100亿英镑(150亿美元)的细胞和基因治疗产业目标。
Ward博士, Cell Therapy Catapult的首席执行官,在他在近期召开的bioProcessUK会上发表了讲话。Cell Therapy Catapult是一个助力英国细胞治疗开发和商业化的政府示范中心。
7、新一代CAR-T已经上路?Autolus募集一亿美元抢占高地
就在一年前,Autolus公司还不为大众所知。然而如今公司已经宣布将进行第二轮总额达六千万美元的融资,这也将目前公司融资总额推高到了1亿美元之多。作为新兴的生物技术公司,Autolus的主要兴趣是开发新一代的CAR-T疗法。而此次融资恰逢CAR-T三大巨头诺华、Juno以及Kite公司争夺首个FDA批准CAR-T疗法药物的风口。因此公司前景可期。
作为从伦敦大学学院剥离而出的生物技术公司,Autolus希望开发出比如今处于申请阶段的CAR-T疗法更安全有效的新一代疗法用于治疗血液瘤以及实体瘤。
肿瘤免疫疗法CAR-T VS PD-1/L1
谁更胜一筹
先说说强大到亮瞎到我猫眼的代言团队:
CAR-T代言人:Emily Whitehead

事件:2012年,June利用还处于临床I期的CAR-T治疗技术,成功挽救身患急性淋巴细胞白血病已经无药可医的7岁小姑娘Emily Whitehead。Whitehead 是第一个接受CAR-T治疗的儿童。至此CAR-T一战成名。
PD-1代言人:美国前总统卡特
事件:2015年12月6日,美国各大主流媒体纷纷隆重报道,美国第39届总统吉米·卡特于6日发表声明说,医生在给他做完最近一次脑部磁力共振扫瞄后,没有发现此前在他大脑中出现的黑色素瘤(melanoma)或新的癌细胞。对神奇药物Keytruda的开发公司默沙东而言,这将是无价的代言!
CAR-T与PD-1/L1在癌症治疗方面各有优势。在肿瘤治疗的PK赛上,我们不希望用“以己之长攻彼之短”,而希望两者可以达到“优势互补”。
作者: 夺标 时间: 2016-5-1 13:47
CAR-T免疫疗法新模式——治疗实体瘤
疫疗法已然成为人类对抗癌症新的希望,而CAR-T疗法则是近年来最有前景的肿瘤免疫疗法之一。CAR-T药物已经成功在人类血液癌症研究中被证明有重要作用,然而针对实体瘤仍然是一个巨大的考验。如果能应用于治疗实体瘤,那将具有很大的潜在市场。
为解决这个难题,科学家们与该领域内的主要公司展开密切的合作。宾夕法尼亚大学医学助理教授Edmund Moon和他们团队已成功地完成了临床前期研究,有助于开辟此道路前进。
Edmund Moon教授主要研究一种关键检查点的抑制性受体PD-1,其是最近刚批准的Nivolumab和Pembrolizumab药物的靶点。由于能产生肿瘤反应的免疫细胞数量较少,这两种药在治疗一些肿瘤中疗效受到一定的限制。
因此Edmund Moon教授和他所带领的团队设计了新一代免疫细胞,通过病毒载体在CAR-T细胞中插入一转基因受体PD1CD28。CAR-T细胞是CD19、间皮素、PSCA这三种关键蛋白的靶标,而这三种蛋白是在肿瘤细胞中表达的。另外,他们还在细胞内设计了PD-1受体,能识别CD28表达的肿瘤细胞内其对应配体PD-L1,从而产生免疫信号。
"我们发现一些肿瘤有很强的侵袭性,并且抵抗其他形式的治疗。我们惊讶地发现,载入PD1CD28的CAR-T细胞相比于没有插入PD1CD28的T细胞,能对小鼠肿瘤模型产生较强的免疫反应,能增加小鼠的存活率。另外,我们还发现其他形式的PD-1受体载入并没有增强CAR-T细胞的免疫效应。"Moon教授称,"我们希望在血液肿瘤中看到的巨大成功,能同样发生在治疗实体肿瘤中。并且,随着我们继续研究其他免疫疗法与T细胞疗法的结合,治疗实体瘤中将会更好地发挥T细胞的功能。"
CAR- T,全称Chimeric Antigen Receptor T-Cell Immunotherapy,即嵌合抗原受体T细胞免疫疗法。可以特异性地识别肿瘤相关抗原,使效应T细胞更具有靶向性、活性和持久性。主要过程是:是从癌症病人身上分离免疫T细胞,利用基因工程技术给T细胞加入一个能识别肿瘤细胞,并且同时激活T细胞杀死肿瘤细胞的嵌合抗体,再经过体外培养,大量扩增CAR-T细胞,然后将细胞输回病人体内。
作者: 夺标 时间: 2016-5-1 13:48
治疗性抗癌疫苗与CAR-T疗法在脑瘤研究方面取得新突破
治疗性抗癌疫苗
高级别神经胶质瘤(glioma)是最具侵袭性的脑癌之一,尽管手术、化疗和放疗能够让病情有所改善,但是这类患者存活超过5年的不到10%。3月2日,发表在《Science Translational Medicine》上的一项研究中,科学家们提出的新一代细胞免疫疗法或将为战胜脑癌带来希望。
细胞免疫疗法是通过注射治疗性抗癌疫苗刺激患者的免疫系统,使之能够攻击肿瘤。在这一研究中,鲁汶大学的科学家们将小鼠的脑癌细胞诱导成了一种特殊的死亡类型。随后,他们将这种垂死的癌细胞与树突状细胞一起培养。结果发现,垂死的癌细胞会释放危险信号,充分激活树突状细胞。
领导该研究的Patrizia Agostinis教授说:“我们将被激活的树突状细胞作为一种治疗性疫苗,重新注射到小鼠体内。观察发现,疫苗能够发出‘警报’,提醒免疫系统癌细胞的存在,并开始攻击脑瘤。”研究显示,结合化疗,这种新型的细胞免疫疗法能够显着提高脑癌小鼠的生存率,几乎50%的小鼠被完全治愈。
Agostinis表示,抗癌治疗的主要目标都是杀死所有的癌细胞,防止任何残余的恶性细胞生长或者再次扩散。然而,仅通过化疗很少能实现这样的目标,很多患者最终病情会复发。这也是为什么免疫系统的共刺激在癌症治疗中如此重要。
近日,CAR-T疗法治疗实体瘤也取得了一项突破进展。发表在《Cancer Immunology Research》上的一项研究中,名古屋大学领导的研究小组发现,一种特殊的免疫细胞能够靶向肿瘤生长中的关键蛋白,帮助阻止脑癌发展。论文的通讯作者Atsushi Natsume说:“我们成功设计了能够特异性靶向podoplanin(PDPN)的CAR-T细胞疗法。”
成胶质细胞瘤(glioblastoma,GBM)是最常见、最具侵袭性的脑瘤之一,中数生存率仅14.6个月,5年生存率不到10%。PDPN是实体瘤发展过程中的一种关键蛋白。研究人员发现,注射他们设计的CAR-T细胞到79只免疫缺陷的小鼠中,成功阻止了其中60%的小鼠成胶质细胞瘤的生长。
论文的共同作者Toshihiko Wakabayashi说:“考虑到PDPN 与GBM的不良预后相关,靶向PDPN的CAR-T疗法给一线化疗后复发或耐药的患者带来了新的希望。尽管这一免疫疗法的临床应用还有很多需要克服的挑战,但这一研究是CAR-T治疗实体瘤的重要里程碑。”(生物谷Bioon.com)
参考文献
《CAR-T Cells Targeting Podoplanin Reduce Orthotopic Glioblastomas in Mouse Brains》
《Dendritic cell vaccines based on immunogenic cell death elicit danger signals and T cell–driven rejection of high-grade glioma》
(原标题:免疫疗法为治愈脑瘤带来新希望!)
作者: 夺标 时间: 2016-5-1 14:01
中科院上海生科院生化与细胞所许琛琦研究组和李伯良研究组合作研究发现:通过调节代谢途径可以调控免疫T细胞的抗肿瘤活性,肿瘤免疫治疗的新靶点—ACAT1以及相应的小分子药物前体的发现,为开发新的肿瘤免疫治疗方法奠定了基础。3月17日相关论文在国际学术期刊《自然》在线发表。
据介绍,在放疗、化疗和手术的基础上,近几年发展起来的肿瘤免疫治疗被认为是对付肿瘤的第四种手段。肿瘤免疫治疗,就是利用人体内免疫系统来清除肿瘤。
许琛琦研究团队和李伯良研究团队将目光聚焦到细胞代谢领域。研究团队锁定了T细胞的细胞内胆固醇代谢通路,当T细胞与肿瘤细胞竞争时,从代谢角度入手增强T细胞对抗肿瘤细胞就成为一种可能。研究团队的代谢线路开创了一个全新的研究角度。
研究发现,当CD8+T细胞开始杀伤免疫细胞时,其吸收、合成胆固醇的水平会提升,而外排胆固醇则降低,但令人困惑的是,此时CD8+T细胞却同时增加了胆固醇的储存水平。科研人员把负责储存的胆固醇酯化酶ACAT1从CD8+T细胞基因敲除后,发现T细胞抗原受体的信号传导陡然增强,杀伤性免疫突触变得更加成熟,CD8+T细胞的增殖能力也大为增加。
曾经进入临床三期的ACAT1小分子抑制剂avasimibe,原本被设计成代谢药物却效果不佳。而在上海科研人员手里,它展现出肿瘤免疫治疗的巨大潜力。在小鼠模型中,该抑制剂具有良好的抗肿瘤效应,与anti-PD-1联动后效果更佳。
| 欢迎光临 汉山 (http://hanshan.info/) |
Powered by Discuz! X3.2 |
















 Tags: 百度 魏则西
Tags: 百度 魏则西 
 Tags: 默沙东 Keytruda 非小细胞肺癌
Tags: 默沙东 Keytruda 非小细胞肺癌 
 Tags: PD-1 临床研究 抗体
Tags: PD-1 临床研究 抗体  Tags: 免疫 肿瘤
Tags: 免疫 肿瘤 
 Tags: 癌症免疫治疗
Tags: 癌症免疫治疗 
 Tags: 肿瘤免疫 治疗
Tags: 肿瘤免疫 治疗 
 Tags: 默克 辉瑞 PD-L1免疫疗法 avelumab entinostat 卵巢癌
Tags: 默克 辉瑞 PD-L1免疫疗法 avelumab entinostat 卵巢癌  Tags: SABCS 乳腺癌 PD-L1 免疫
Tags: SABCS 乳腺癌 PD-L1 免疫 






 Tags: 肿瘤免疫 治疗
Tags: 肿瘤免疫 治疗 










